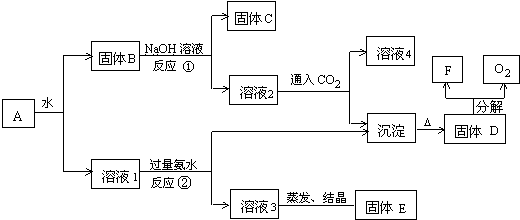
题目内容
15.一定温度下,有式量为M的某物质的饱和溶液V mL,密度为p g•cm-3,该溶液的物质的量浓度为 cmol/L,溶质的质量分数为w,溶液中溶质的质量为mg,此物质在该温度下的溶解度为Sg,则下列表示式中正确的是( )| A. | m=p•V•w% | B. | w=$\frac{cM}{2000p}$% | C. | S=$\frac{m}{pV-m}$ | D. | c=$\frac{1000m}{VM}$ |
分析 A、溶质的质量m=m液•w%;
B、溶质的质量分数w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%;
C、溶解度是指在100g水中达到饱和时所能溶解的溶质的质量;
D、溶液的物质的量浓度c=$\frac{{n}_{溶质}}{{V}_{溶液}}$.
解答 解:A、此饱和溶液V mL,密度为p g•cm-3,故此溶液的质量为pVg,而溶质的质量分数为w,故溶质的质量m=p•V•w,故A错误;
B、此饱和溶液V mL,密度为p g•cm-3,故此溶液的质量为pVg;而溶液中溶质的物质的量为cmol/L×VmL×10-3=10-3CVmol,质量m=10-3CVmol×Mg/mol=10-3CVMg,故溶液的质量分数w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{1{0}^{-3}CVM}{PV}×100%$=$\frac{cM}{10P}%$,故B错误;
C、此饱和溶液V mL,密度为p g•cm-3,故此溶液的质量为pVg,而其中溶质的质量为mg,故水的质量为(PV-m)g,即mg溶质在(PV-m)g水中达到饱和,
则有:mg~(PV-m)g
sg~100g
可有:$\frac{m}{s}=\frac{pV-m}{100}$
可知s=$\frac{100m}{pV-m}$,故C错误;
D、溶液中溶质的物质的量为$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,溶液的体积为V×10-3L,故溶液的物质的量浓度c=$\frac{{n}_{溶质}}{{V}_{溶液}}$=$\frac{\frac{m}{M}mol}{V×1{0}^{-3}mol}$=$\frac{1000m}{MV}$mol/L,故D正确.
故选D.
点评 本题考查了溶液中各种量的计算,由于是用符号来表示,所以难度相对较大,利用公式来分析是关键.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CuCl2+2 NaOH═Cu(OH)2↓+2NaCl | ||
| C. | FeO+2 HCl═FeCl2+H2O | D. | 2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O |
| A. | Fe(NO3)3溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH+4 | |
| B. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 氯化铵溶液与氢氧化钠溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应::Ba2++SO42-═BaSO4↓ |
| A. | 精炼铜的阳极泥中可回收金、银等贵金属 | |
| B. | 废旧金属是一种固体废弃物,会污染环境 | |
| C. | 废旧金属的回收利用,即能防止环境污染,又能缓解资源短缺矛盾 | |
| D. | 废旧金属回收利用的成本比从矿石中冶炼出等量的金属成本高 |
| A. | Al3+、Na+、SO42-、Br- | B. | Na+、NH4+、NO3-、I- | ||
| C. | K+、Mg2+、Fe3+、Cl- | D. | Na+、AlO2-、SO42-、CO32- |
| A. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中由水电离产生的c(OH-)相等 | |
| B. | 中和 0.1 mol•L-1 醋酸与中和 0.01 mol•L-1的醋酸所需同种碱溶液的物质的量不同 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
 二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).