题目内容
【题目】下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
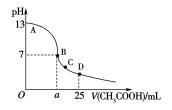
D.若![]() LpH=11的NaOH溶液与
LpH=11的NaOH溶液与![]() LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则![]() ≤
≤![]()
【答案】C
【解析】
A、将pH=4的盐酸稀释后,溶液中氢离子和氯离子的浓度降低,但温度不变,Kw不变,氢氧根离子的浓度升高,错误;
B、0.l0mol·L-1的氨水加水稀释后,虽然一水合氨的电离平衡正向移动,但由于溶液体积的增大起主要作用,溶液中c(NH4+)、c(OH-)变小,错误;
C、Na2CO3水解呈碱性,常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变,正确;
D、V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,若HA为强酸,则V1=V2,若HA为弱酸,则V1>V2,错误;
答案选C。

练习册系列答案
相关题目
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
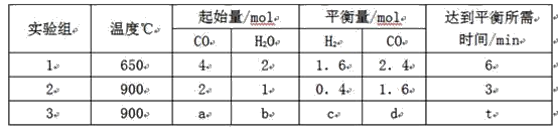
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等