题目内容
二甲醚(CH3OCH3)是一种新型的合成“柴油”.它可由生物甲烷或天然气合成.
(1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
![]() ,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162 kg,在微生物作用下完全转化可得CH4在标准状况下的体积为________m3.
,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162 kg,在微生物作用下完全转化可得CH4在标准状况下的体积为________m3.
(2)合成二甲醚主要步骤为造气和合成.过程如下:

若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其它杂质,每100 m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2且体积比为4∶1,下同),才能保证合成时CO和H2充分利用.V[H2O(g)]=________m3;V(空气)=________m3.
(3)为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O→CO+3H2 ②2CH4+O2→2CO+4H2
合成塔I:CO+2H2→CH3OH,2CH3OH→CH3OCH3+H2O;
合成塔II:![]()
假设天然气中只含CH4,反应②中通入适量空气,通过调节①和②中投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰为3∶1,以便合成氨.该企业每生产34tNH3理论上同时可以得到二甲醚多少吨(设工业经多次转化,总转化率假定为100%,设合成塔I中水与CO不反应)?
解析:
|
(1)由题意知(C6H10O5)n+nH2O 3nCH4↑+3nCO2↑ 162n 3n (2)要保证CO和H2的充分利用,则只能是生成的CO和H2必须是1∶2.在100 m3的天然气中有CH495 m3和CO25 m3.解设通入的水蒸气为Xm3,则有 所以有 (3)80.5 t |

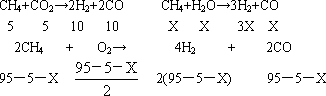

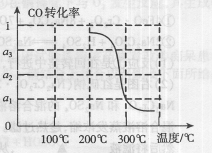
 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。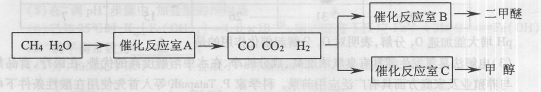
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。