题目内容
某含Na+的溶液中可能含有NH4+、Fe3+、Br-、CO32-、I-、SO32-.取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象.为确定该溶液的组成,还需进行的实验有( )
分析:①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,依据离子共存分析则溶液中不可能 存在Fe3+,溶液呈橙黄色,说明可能生成I2或Br2;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-.判断含有Br-;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-.判断含有Br-;
解答:解:①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,依据离子共存分析溶液中不可能存在Fe3+,溶液呈橙黄色,说明可能生成I2或Br2;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-.一定存在Br-;
所以溶液中一定不存在I-、SO32-,Fe3+;
一定存在Br-、CO32-,
由于没有涉及到NH4+离子的性质,则NH4+不能确定是否存在,需要进一步实验验证铵根离子的存在,方法为:取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体;
故选B.
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-.一定存在Br-;
所以溶液中一定不存在I-、SO32-,Fe3+;
一定存在Br-、CO32-,
由于没有涉及到NH4+离子的性质,则NH4+不能确定是否存在,需要进一步实验验证铵根离子的存在,方法为:取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体;
故选B.
点评:本题考查了常见阳离子、阴离子的检验方法和反应现象分析,离子共存的分析判断是离子检验的基本方法,题目难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
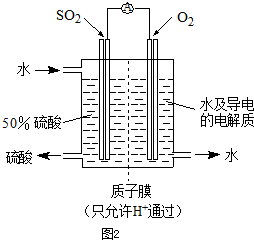
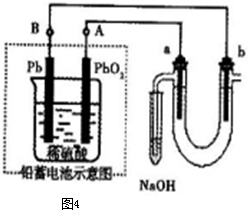
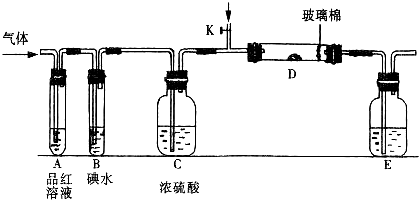
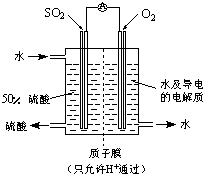

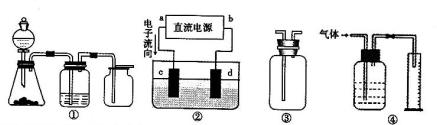
 入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的
入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的 是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。 酸 C.硝酸钾溶
酸 C.硝酸钾溶 液 D.硫化钠溶液
液 D.硫化钠溶液 l2与含X的溶液反应的离子方程式 。
l2与含X的溶液反应的离子方程式 。

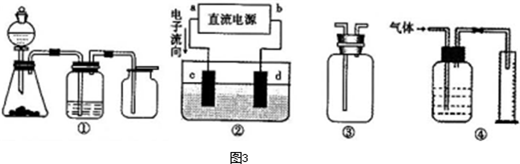
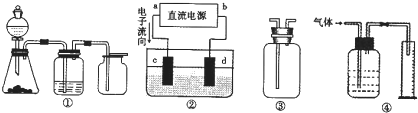
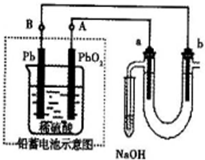
 ,a为正扳,d为阳极
,a为正扳,d为阳极 2、NH3、Cl2,、HCl、NO2等
2、NH3、Cl2,、HCl、NO2等 .装置④能用于测量气体体积
.装置④能用于测量气体体积