题目内容
Na2O2常用来作高空飞行和潜水时的供氧剂,工业上制备过氧化钠的方法是:将金属钠加热至熔化,通入一定量已除去CO2的干燥空气,加热并维持温度在180-200 ℃之间,钠被氧化成Na2O,进而增加空气流量,迅速升温至300~400 ℃,制得过氧化钠。据此原理,欲在实验室制备少量过氧化钠,请回答: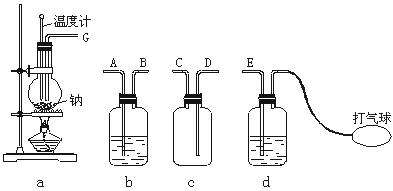
(1)下列装置应如何连接(写出各接口端序号)?__________________。
(2)各广口瓶中应装入的试剂是__________________。
(3)除去空气中CO2和水的目的是__________________。
解析:过氧化钠的制备原理是:4Na+O2![]() 2Na2O;
2Na2O;
O2+2Na2O![]() 2Na2O2。
2Na2O2。
因此,反应装置必须具备加热、密封及温度指示功能。由于空气中的CO2和H2O都能与Na、Na2O和Na2O2反应,在向反应器中通入空气时必须除去CO2和H2O,这就需要具有以下功能的装置:①鼓气,②吸收CO2,③吸收水。整个制备过程必需的装置应是a,b,d。为防止洗气液进入反应器,在洗气装置和反应装置之间应连接一个安全装置c。其连接的顺序应是:E&A,B&C,D&G。
在d瓶中装NaOH溶液(除去CO2及其他酸性气体),在b瓶中盛浓硫酸除水蒸气。
Na2O2、Na2O与CO2和水都可以反应,生成Na2CO3和NaOH,为制得纯净的Na2O2,必须除去空气中的CO2和水。
答案:(1)E-A,B-C,D-G (2)d中装NaOH溶液,b中装浓H2SO4
(3)防止CO2和水与Na、Na2O、Na2O2反应生成杂质

(12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔;为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
为 L。
(2)14.48g该混合物中n((NH4)2SO4)= mol n(NH4HSO4)= mol
(3)第4组中过量的NH4+ 的物质的量为: mol
(12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔; 为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
1 |
3.62 |
50.00 |
0.896 |
|
2 |
7.24 |
50.00 |
1.792 |
|
3 |
10.86 |
50.00 |
2.016 |
|
4 |
14.48 |
50.00 |
1.568 |
(1)由第1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)
为 L。
(2)14.48g该混合物中n((NH4)2SO4)= mol n(NH4HSO4)= mol
(3)第4组中过量的NH4+ 的物质的量为: mol