题目内容
17.把煤作为燃料可通过下列两种途径:途径Ⅰ:C(s)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$CO2(g) (1mol碳单质反应放热Q1 kJ)
途径Ⅱ:先制水煤气 C(s)+H2O(g) $\frac{\underline{\;点燃\;}}{\;}$CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
再燃烧水煤气 2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)
2H2(g)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
试回答下列问题:
(1)当等物质的量的单质碳反应时,途径Ⅰ放出的热量等于 (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(2)Q1、Q2、Q3 的数学关系式是Q1=$\frac{Q{\;}_{3}}{2}$-Q2.
(3)由于制取水煤气反应里,反应物所具有的总能量低于生成物所具有的总能量生成物所具有的总能量,那么在化学反应时,反应物就需要吸收能量才能转化为生成物,因此其反应条件为高温.
(4)简述煤通过途径Ⅱ作为燃料的意义:固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送.
分析 (1)根据盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同来判断;
(2)根据由盖斯定律可知:①C(s)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$CO2(g) (1mol碳单质反应放热Q1 kJ)
②C(s)+H2O(g) $\frac{\underline{\;点燃\;}}{\;}$CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
③2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)
2H2(g)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
根据盖斯定律①=$\frac{③}{2}$-②计算;
(3)根据吸热反应中,反应物所具有的总能量小于生成物所具有的总能量以及能量守恒;
(4)根据煤通过途径Ⅱ作为燃料燃烧后产物无污染、燃烧效率高等.
解答 解:(1)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,故答案为:等于;
(2)由盖斯定律可知:①C(s)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$CO2(g) (1mol碳单质反应放热Q1 kJ)
②C(s)+H2O(g) $\frac{\underline{\;点燃\;}}{\;}$CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
③2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)
2H2(g)+O2(g) $\frac{\underline{\;点燃\;}}{\;}$2H2O(g)(1molCO和1molH2反应共放热Q3 kJ)
根据盖斯定律①=$\frac{③}{2}$-②,所以Q1=$\frac{Q{\;}_{3}}{2}$-Q2;故答案为:Q1=$\frac{Q{\;}_{3}}{2}$-Q2;
(3)因吸热反应中,反应物所具有的总能量小于生成物所具有的总能量,以及在化学反应中能量守恒,所以反应物就需要吸收能量才能转化为生成物,故答案为:低于;吸收;高温;
(4)因煤通过途径Ⅱ作为燃料燃烧后产物无污染、燃烧效率高等,
故答案为:固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送.
点评 本题主要考查了盖斯定律的应用,同时还考查了煤的气化,难度不大.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 电解稀硫酸溶液实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH-4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
| A. | 该反应的平衡常数表达式为k=$\frac{{c}^{3}(C)•c(D)}{{c}^{2}(A)•{c}^{3}(B)}$ | |
| B. | 升高温度,该反应的平衡常数增大 | |
| C. | 从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L•min) | |
| D. | B的平衡转化率为60% |
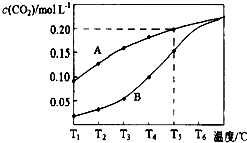 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:(1)该反应正反应为吸热反应(填吸或放),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为0.2.
(2)如果该反应的平衡常数K值变大,该反应bc(选填编号).
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:随着温度升高,反应速率加快,达到平衡所需要的时间变短.
| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
(5)已知苯酚和碳酸的电离平衡常数如图所示请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式C6H5O-+CO2+H2O→C6H5OH+HCO3-,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据二氧化碳与水结合生成碳酸,且碳酸酸性比苯酚酸性强,故能生成苯酚.碳酸的电离分两步:第一步:H2CO3?H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-?H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡.
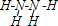 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.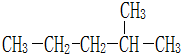 :2-甲基戊烷;
:2-甲基戊烷;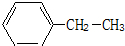 乙苯
乙苯 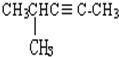 4-甲基-2-戊炔.
4-甲基-2-戊炔.