题目内容
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A. CH3OCH3(g)+3H2O(g) ![]() 6H2(g) + 2CO2(g): △H>0
6H2(g) + 2CO2(g): △H>0

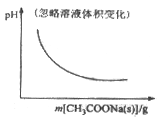
B. CH3COOH![]() H++CH3COO-
H++CH3COO-
C. FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl

D. N2(g) +3H2(g)![]() 2NH3(g)
2NH3(g)

【答案】A
【解析】A、因反应为吸热反应,则压强不变时,升高温度,平衡正向移动,则甲醚的转化率增大,与图中相符合,A正确;B、CH3COOH溶液中存在电离平衡,加入醋酸钠固体,电离平衡逆向移动,c(H+)减小,pH逐渐增大,与图中不符合,B错误;C、因该反应中K+、Cl-实际不参加反应,则加入KCl对平衡体系无影响,化学平衡不移动,铁离子的浓度不变,与图中不符合,C错误;D、恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度减小(等效于减压),化学平衡朝体积增大方向移动,反应逆向进行,H2的改变量减小,起始量不变,转化率减小,图中不符合,D错误;答案选A。

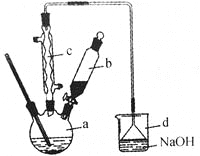
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g﹒cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须要做的是 (填入正确操作前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取