题目内容
已知铜能被稀硝酸溶解,其反应的化学方程式如下
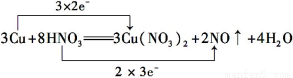
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应的电子转移情况(只需标出电子得失的方向和数目)__________________________________________________________________。
(2)上述反应中氧化剂是 ,氧化产物是 。
(3)上述反应中氧化剂与还原剂的物质的量之比为 。
(4)若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是 。
(1)
(2)HNO3 Cu(NO3)2
(3)2∶3
(4)4.48 L
【解析】
试题分析:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,
则双线桥法标出电子得失的方向和数目为 ,
,
故答案为: ;
;
(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物;(3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,由反应及氮原子守恒可知,8mol硝酸反应时6mol硝酸体现酸性,2mol硝酸体现氧化性,3mol铜体现了还原性,故氧化剂与还原剂的物质的量之比为2:3;(4)由反应可知生成2molNO转移的电子为6mol,则反应中转移了0.6mol电子,产生的气体的物质的量为0.2mol,其在标准状况下的体积为0.2mol×22.4L/mol=4.48L。
考点:氧化还原反应;硝酸的化学性质。

就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是: 。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法: 。