题目内容
10. 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.①A仪器的名称是蒸馏烧瓶,B仪器的名称是冷凝管.
②图中的两处明显的错误是冷凝水方向、温度计位置错误.
分析 实验室用自来水制取蒸馏水用蒸馏的方法制备,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用.
解答 解:(1)由仪器的结构可知,A为蒸馏烧瓶,B为冷凝管,故答案为:蒸馏烧瓶;冷凝管;
(2)温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,故答案为:冷凝水方向;温度计位置错误.
点评 本题考查实验室制备蒸馏水操作,题目难度不大,本题注意实验操作要点,学习中注意正确操作方法和实验的注意事项.

练习册系列答案
相关题目
20.实验室中能用磨口玻璃瓶保存的是( )
| A. | NaOH | B. | 盐酸 | C. | 水玻璃 | D. | 氢氟酸 |
1.下列说法正确的是( )
| A. | 形成离子键的阴阳离子只存在静电吸引力 | |
| B. | 元素周期律是元素的原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增加 | |
| D. | 离子化合物中只能含离子键、极性共价键 |
18.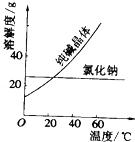 阅读、分析下列两个材料:
阅读、分析下列两个材料:
材料一(如图):
材料二:
选择回答下列问题(填写序号):A.分液法 B.“溶解成热饱和溶液、冷却结晶、过滤”的方法 C.“溶解、蒸发结晶、趁热过滤”的方法 D.蒸馏法 E.过滤法 F.萃取法
①将乙二醇和丙三醇相互分离的最佳方法是D.
②提取碘水中的碘,可综合选用上述三种方法依次是F、A、D.
③将含有氯化钠杂质的纯碱提纯出来,最好应用B.
 阅读、分析下列两个材料:
阅读、分析下列两个材料:材料一(如图):
材料二:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
①将乙二醇和丙三醇相互分离的最佳方法是D.
②提取碘水中的碘,可综合选用上述三种方法依次是F、A、D.
③将含有氯化钠杂质的纯碱提纯出来,最好应用B.
5.反应物和生成物均为气态的平衡体系,平衡常数表达式为:K=$\frac{c(x)•{c}^{2}(y)}{{c}^{3}(z)•{c}^{2}(w)}$,有关该平衡体系说法不正确的是( )
| A. | 升高温度,该反应平衡常数K的变化无法判断 | |
| B. | 增大压强,W的质量分数减小 | |
| C. | 该反应的化学方程式为:3z(g)+2w(g)?x(g)+2y(g) | |
| D. | 增大X气体浓度平衡向正反应方向移动 |
15.在酸性溶液中,下列各组离子能大量共存的是( )
| A. | NH${\;}_{4}^{+}$、K+、Al3+、SO${\;}_{4}^{2-}$ | B. | Cl-、I-、K+、MnO${\;}_{4}^{-}$ | ||
| C. | Na+、S2O${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | D. | Na+、NO${\;}_{3}^{-}$、PO${\;}_{4}^{3-}$、Cl- |
2.催化剂的研究是化学反应原理中的一个重要领域,下列有关叙述正确的是( )
| A. | 加催化剂可以增大或减小化学反应的焓变 | |
| B. | 催化剂能降低反应所需活化能 | |
| C. | 任何化学反应都需要活化能的推动 | |
| D. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比例 |
19.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 64g SO2含有NA个SO2分子 | |
| C. | 16g CH4所含的电子数为NA | |
| D. | 标况下,4.48L的水中含有H2O分子的数目为0.2NA |