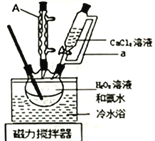
题目内容
【题目】下列有关原子结构和元素周期律表述正确的是
A. ⅦA族元素是同周期中非金属性最强的元素
B. 原子序数为15的元素的最高化合价为+3
C. 原子序数为12的元素位于元素周期表的第三周期ⅡA族
D. 第二周期ⅣA族元素的原子核电荷数和中子数一定为6
【答案】AC
【解析】A、同周期自左而右,非金属性增强,所以ⅦA族元素是同周期中非金属性最强的元素,故A正确;B、主族元素最高正化合价等于原子最外层电子数,原子序数为15的元素是磷元素,最外层电子数为5,该元素的最高化合价为+5,故B错误;C、原子序数为12的元素为镁,位于元素周期表的第三周期ⅡA族,故C正确;D、第二周期ⅣA族元素为碳元素,原子核电荷数一定为6,中子数不一定是6,如有核素![]() ,故D错误。故选AC。
,故D错误。故选AC。

练习册系列答案
相关题目