题目内容
1.钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCI4:2FeTiO3+7Cl2+6C═2TiCI4+2FeCl3+6CO TiO2+2Cl2+2C═TiCI4+2CO
将TiCI4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCI4+2Mg═Ti+2MgCI2
MgCI2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭.
请回答下列问题:
(1)基态钛原子的价电子排布式为3d24S2.
(2)与CO互为等电子体的离子为CN-(填化学式).
(3)在CH2CI2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有CO2.
(4)TiCI4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCI4属于分子(填“原子”、“分子”或“离子”)晶体.
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCI2溶液时,现象是产生白色沉淀;往另一种配合物的溶液中加入BaCI2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为[Co(NH3)5SO4]Br.
分析 (1)钛(Ti)是22号元素,原子核外电子数为22,根据核外电子排布规律书写;
(2)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体;
(3)根据价电子对互斥理论确定原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
(4)根据题目中提供的物理性质TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟来判断晶体类型;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,[Co(NH3)5Br]SO4,说明硫酸根离子在外界,加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明第二种配合物溴离子为配合物的外界离子,据此书写.
解答 解:(1)钛(Ti)是22号元素,原子核外电子数为22,、基态钛原子的电子排布式1s22s22p63s23p63d24S2,则价电子排布式为:3d24S2,
故答案为:3d24S2;
(2)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,如果是阳离子离子,原子序数之和减去所带电荷数值等于电子数,如:NO+,O22+,如果是阴离子,原子序数之和加上所带电荷数值等于电子数,如CN-,C22-;
故答案为:CN-;
(3)CH2CI2中价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4且不含孤电子对,所以C原子采用sp3杂化,C6H6连接3个原子,形成3个θ键,无孤电子对,属于sp2杂化,CO2分子中C原子价层电子对个数是2且不含孤电子对,为直线形分子,所以碳原子采取sp杂化,C2H4中每个碳原子价层电子对个数为3且不含孤电子对,所以C原子采用sp2杂化,
故答案为:CO2;
(4)因TiCl4在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体,
故答案为:分子;
(5)[Co(NH3)5Br]SO4在水溶液中可电离出SO42-,往其溶液中加BaCl2溶液时,现象为产生白色沉淀,往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,说明不能电离出SO42-,若加入AgNO3溶液时,产生淡黄色沉淀,说明能电离出Br-,则第二种配合物的化学式为[Co(NH3)5SO4]Br.
故答案为:产生白色沉淀;[Co(NH3)5SO4]Br.
点评 本题考查物质结构知识,知识点较综合,原子杂化方式的判断、原子核外电子排布式的书写等知识点是高考热点,应重点掌握,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 选项 | 实验操作及现象 | 实验结论 |
| A | 食醋浸泡水垢产生无色气体 | 乙酸的酸性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合,橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 用铝制容器保存浓硝酸 | 浓硝酸与铝不发生化学反应 |
| D | 碘酒滴到土豆片上变蓝 | 淀粉遇碘单质变蓝 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 所有卤代烃都是难溶于水,密度比水小的液体 | |
| B. | 所有卤代烃在适当条件下都能发生消去反应 | |
| C. | 所有卤代烃都含有卤原子 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
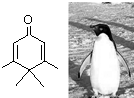
| A. | Penguinone是一种芳香烃 | |
| B. | Penguinone的分子式为C9H12O | |
| C. | Penguinone的一氯取代产物有4种 | |
| D. | 1molPenguinone最多能与3 mol H2发生加成反应 |
| A. | 反应热可分为多种,如燃烧热、中和热、溶解热等 | |
| B. | 氢气是一种燃烧热高,来源丰富,环保的一级能源 | |
| C. | 达化学平衡时,同一物质的正反应速率一定等于其逆反应速率 | |
| D. | 由自由能判据推出反应2CO(g)═2C(s)+O2(g)在任何温度下都不能自发进行 |
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中可能含有氧原子 | D. | 有机物的分子式为CH4Ox(x=O、1) |
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| C. | 鉴别己烯和苯:向己烯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| D. | 除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、HCl、Na2CO3 |
( )
| A. | 乙烷 | B. | 苯 | C. | 乙烯 | D. | 乙醇 |