题目内容
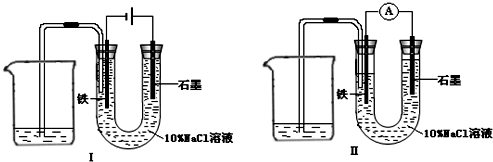
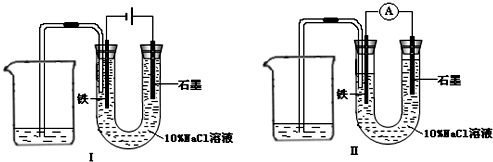
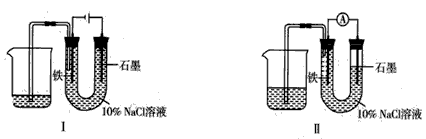
如用图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法不正确的是( )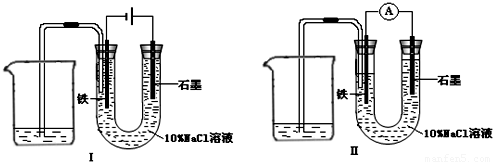
A.同温、同压下,装置I中石墨电极上方得到气体的体积与铁电极上方得到气体的体积相等
B.用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2
C.用装置Ⅱ进行实验时石墨电极的电极反应为 Cl2+2e-═2Cl-
D.装置I通电10分钟后铁电极周围溶液的pH值上升
【答案】分析:装置I是电解池,装置Ⅱ是原电池.
A、根据溶液的酸碱性和气体的溶解性判断生成气体体积的相对大小.
B、装置Ⅱ是原电池,原电池放电时,较活泼的金属铁作负极,负极上失电子发生氧化反应.
C、装置Ⅱ是原电池,原电池放电时,较不活泼且导电的石墨作正极,氯气在正极上得电子发生还原反应.
D、根据电解时溶液中生成物的酸碱性判断溶液的PH值变化.
解答:解:A、该装置是原电池,石墨是阳极,阳极上氯离子放电生成氯气,铁作阴极,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,溶液呈碱性,氯气部分溶于溶液导致同温、同压下,装置I中石墨电极上方得到气体的体积小于铁电极上方得到气体的体积,故A错误.
B、电解后溶液呈碱性,含有氢氧化钠,装置Ⅱ是原电池,铁作负极,原电池放电时,铁失去电子生成二价铁离子,二价铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,所以电极反应式为Fe-2e-+2OH-═Fe(OH)2,故B正确.
C、装置Ⅱ是原电池,石墨作正极,石墨上的氯气得电子生成氯离子,所以电极反应式为Cl2+2e-═2Cl-,故C正确.
D、装置I通电10分钟后,铁电极上氢离子放电导致铁电极周围氢氧根离子浓度大于氢离子浓度,所以溶液的pH值上升,故D正确.
故选A.
点评:本题考查了原电池和电解池原理,难度不大,易错选项是A,注意相同条件下,部分氯气能和水反应导致生成的氯气的体积小于氢气的体积.
A、根据溶液的酸碱性和气体的溶解性判断生成气体体积的相对大小.
B、装置Ⅱ是原电池,原电池放电时,较活泼的金属铁作负极,负极上失电子发生氧化反应.
C、装置Ⅱ是原电池,原电池放电时,较不活泼且导电的石墨作正极,氯气在正极上得电子发生还原反应.
D、根据电解时溶液中生成物的酸碱性判断溶液的PH值变化.
解答:解:A、该装置是原电池,石墨是阳极,阳极上氯离子放电生成氯气,铁作阴极,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,溶液呈碱性,氯气部分溶于溶液导致同温、同压下,装置I中石墨电极上方得到气体的体积小于铁电极上方得到气体的体积,故A错误.
B、电解后溶液呈碱性,含有氢氧化钠,装置Ⅱ是原电池,铁作负极,原电池放电时,铁失去电子生成二价铁离子,二价铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,所以电极反应式为Fe-2e-+2OH-═Fe(OH)2,故B正确.
C、装置Ⅱ是原电池,石墨作正极,石墨上的氯气得电子生成氯离子,所以电极反应式为Cl2+2e-═2Cl-,故C正确.
D、装置I通电10分钟后,铁电极上氢离子放电导致铁电极周围氢氧根离子浓度大于氢离子浓度,所以溶液的pH值上升,故D正确.
故选A.
点评:本题考查了原电池和电解池原理,难度不大,易错选项是A,注意相同条件下,部分氯气能和水反应导致生成的氯气的体积小于氢气的体积.

练习册系列答案
相关题目