题目内容
【题目】赤泥是铝土矿提取氧化铝过程中产生的固体废弃物,其主要成分为Fe2O3、Al2O3、CaO、TiO2、SiO2等,属于强碱性废渣。从赤泥中回收钛的工艺流程如下:
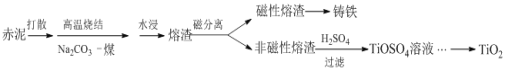
请回答以下问题:
(1)赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了化学中和反应,其次是______。
(2)赤泥加一定量水打散的目的是______。
(3)已知高温烧结时,TiO2发生的反应是Na2CO3+TiO2 ![]() Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
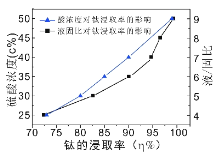
(4)酸浸时,若使钛的浸出率(η%)达到90%,则根据右图工业上应采取的适宜条件是:酸浓度和液固比的取值分别约为______、______。同时浸出温度过高可能造成的环境污染是__________。
(5)TiO2在一定条件下可转化为TiCl4而获得精制提纯,控制TiCl4水解的条件还可以制得TiO2·xH2O纳米材料,该水解过程的化学方程式是______。
(6)赤泥中含钛(以TiO2的质量分数表示)一般为4% ~12%,假设在上述工艺中钛的总回收率为75%,则1t赤泥获得TiO2的最大质量为______kg。
【答案】物理吸附 增大赤泥的接触面积,且打散后便于搅拌 Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ Na2SiO3、NaAlO2 40% 6 会形成大量的酸雾 TiCl4+(x+2)H2O=TiO2·xH2O↓+4HCl 90
2NaAlO2+CO2↑ Na2SiO3、NaAlO2 40% 6 会形成大量的酸雾 TiCl4+(x+2)H2O=TiO2·xH2O↓+4HCl 90
【解析】
(1)赤泥颗粒孔隙大,具有较大的比表面积,吸附力强分析;
(2)水加入可使物质松散,扩大接触面积;
(3)在高温烧结时,Na2CO3与TiO2、Al2O3、SiO2会发生反应,产生相应的盐,反应后向生成物中加水,其中可溶性的盐进入溶液中,难溶性的物质仍以固体形式存在;
(4)根据钛的浸出率与硫酸浓度与固液比例分析判断;根据高温盐分解产物的状态判断影响;
(5)根据TiCl4是强酸弱碱盐,在溶液中发生盐的水解反应分析;
(6)根据Ti元素守恒分析解答。
(1)赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了赤泥含有大量的Fe2O3、Al2O3、CaO、TiO2金属氧化物,可以与酸性氧化物SO2反应产生亚硫酸盐,其次就是其由于颗粒孔隙大,具有较大的比表面积,吸附力强;
(2)赤泥是固体物质,加一定量水打散,可以增大赤泥的接触面积,便于吸收SO2气体,且打散后便于搅拌,反应更容易进行;
(3)在高温烧结时,Na2CO3与Al2O3发生反应:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;Na2CO3与SiO2发生反应:Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3与SiO2发生反应:Na2CO3+SiO2![]() Na2SiO3+CO2↑;Na2CO3与TiO2发生的反应是Na2CO3+TiO2
Na2SiO3+CO2↑;Na2CO3与TiO2发生的反应是Na2CO3+TiO2 ![]() Na2TiO3+CO2↑,由于NaAlO2、Na2TiO3都是可溶性的物质,而Na2TiO3是难溶性的物质,所以高温烧结后水浸反应产物,水浸液里的主要溶质有Na2SiO3、NaAlO2;
Na2TiO3+CO2↑,由于NaAlO2、Na2TiO3都是可溶性的物质,而Na2TiO3是难溶性的物质,所以高温烧结后水浸反应产物,水浸液里的主要溶质有Na2SiO3、NaAlO2;
(4)根据图示中钛的浸出率与硫酸浓度与固液比例关系,画一条垂直于钛的浸出率90%的线,与硫酸浓度线的交点是40%,与液固比例线的交点是6,可确定需要硫酸酸浓度约为40%,液固比的取值约为6。同时若浸出温度过高,酸溶解钛的氧化物形成的盐可能会发生分解反应,产生酸性气体,污染环境,故浸取温度不宜过高;
(5)TiCl4是强酸弱碱盐,在溶液中Ti4+发生盐的水解反应,消耗水电离产生OH-,最终使溶液显酸性,根据题意可知水解产生TiO2·xH2O和HCl,反应的化学方程式为TiCl4+(x+2) H2O=TiO2·xH2O↓+4HCl;
(6)假设赤泥中TiO2的质量分数12%,1t赤泥中TiO2的质量为m(TiO2)=1000kg×12%=120kg;由于在上述工艺中钛的总回收率为75%,所以实际最多可获得TiO2的质量为120kg×75%=90kg。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
Ⅰ.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131 kJ/mol
CO(g)+H2(g) ΔH=+131 kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol
CH4(g)+H2O(g) ΔH=a kJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 | C≡O | H-H | H-C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)则反应②中a=______。
(2)煤直接甲烷化反应C(s)+2H2 (g)![]() CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1 mol CO2和2.5 mol H2,发生反应: 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
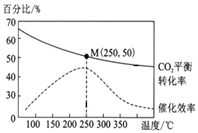
(3)图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是______。
(4)250℃时,该反应的平衡常数K值为______。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入1 molCO2和3 molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5)反应前1小时内的平均反应速率v(H2)为______mol/(L·h),该温度下CO2的平衡转化率为______。
Ⅳ.电解逆转化制乙醇
(6)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在______极(填“阴”或“阳”),该电极的反应式为______。


