题目内容
15.某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将112.0L混合气体通入足量溴水,溴水质量增重70.0g,通过计算回答:(1)混合气体中气态烷烃的化学式:CH4
(2)混合气体中两种气体的物质的量之比:3:1
(3)写出混合气体中气态烯烃可能的结构简式:CH2=CH-CH2CH3、CH3-CH=CH-CH3、CH2=C(CH3)2.
分析 (1)相同条件下,密度之比等于相对分子质量之比,据此计算混合气体的相对分子质量,进而确定含有的烷烃;
(2)根据n=$\frac{V}{{V}_{m}}$计算112L混合气体的物质的量,再根据m=nM计算混合气体的质量,溴水质量增重70.0g为烯烃的质量,进而计算烷烃的质量与物质的量,再计算烯烃的物质的量,据此进行解答;
(3)由烯烃的质量与物质的量,根据M=$\frac{m}{n}$计算其摩尔质量,据此计算烯烃的分子式,书写可能的结构.
解答 解:(1)在同温同压下,混合气体对氢气的相对密度为13,故混合气体的平均相对分子质量为13×2=26,烯烃的最小相对分子质量为28,则混合烃中一定含有甲烷,
故答案为:CH4;
(2)标况下112L混合气体的物质的量为:$\frac{112L}{22.4L/mol}$=5mol,故混合气体的总质量为:5mol×26g/mol=130g,溴水质量增重70.0g为烯烃的质量,故甲烷的质量为130g-70g=60g,
故甲烷的物质的量为:$\frac{60g}{16g/mol}$=3.75mol,烯烃的物质的量为5mol-3.75mol=1.25mol,则n(CH4):n(C4H8)=3.75mol:1.25mol=3:1,
故答案为:3:1;
(3)烯烃的摩尔质量为$\frac{70g}{1.25mol}$=56g/mol,设烯烃的组成为(CH2)n,则:14n=56,解得:n=4,故该烯烃为C4H8,该烯烃可能的结构为:CH2=CH-CH2CH3、CH3-CH=CH-CH3、CH2=C(CH3)2,
故答案为:CH2=CH-CH2CH3、CH3-CH=CH-CH3、CH2=C(CH3)2.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,根据平均相对分子质量确定含有甲烷是解题的关键,注意熟练掌握常见有机物结构与性质.

(1)此流程的第II步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是②③.
①v(CO2)正=v(H2O)逆 ②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)如图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸气的量(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).

| A. | Cl2是一种黄绿色、密度比空气大的有毒气体 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧FeCl3 | |
| C. | 当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 | |
| D. | Cl2的氧化性比Br2强,而Br-的还原性却比Cl-强 |
| A. | 0.005 | B. | 0.01 | C. | 0.002 | D. | 0.05 |
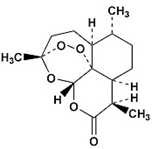 我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )
我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面上 | |
| B. | 分子中含氧官能团只有酯基 | |
| C. | 青蒿素的化学式是C15H22O5 | |
| D. | 青蒿素属于烃类有机物 |
| A. | 每消耗1molN2的同时消耗2molNH3 | |
| B. | 相同时间内消耗28gN2与消耗6gH2的反应速率相同 | |
| C. | 当v(N2)=3v(H2)时表示反应已达平衡 | |
| D. | 2min内H2减少3mol,则v(N2)=0.5mol/(L•min) |
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”、“放热”).
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选不得分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定.
| A. | 单质硅是将太阳能转变为电能的常用材料 | |
| B. | SiO2与酸、碱均不反应 | |
| C. | 因为SiO2有导电性,故SiO2可用于制备光导纤维 | |
| D. | 向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,说明H2SiO3的酸性比H2CO3的酸性强 |
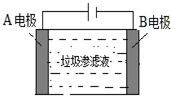 垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到
垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到