题目内容
某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑.
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究.
步骤一:提出假设:: .
步骤二:查阅资料.得出:①+1价的铜在酸性条件下易发生自身氧化还原反应;
②在空气中灼烧氧化亚铜生成氧化铜.
步骤三:设计方案、实验.
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出.
你认为合理的方案是(填字母) .
(2)乙小组针对甲小组的假设,另设计如图装置进行验证.
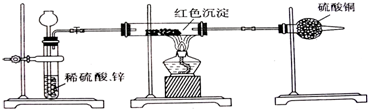
若按乙组装置定性检验上述红色沉淀成分,可根据 现象的发生与否即可判断.
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量 (填序号).
①通入氢气的体积;
②反应前红色沉淀和硬质玻管的总质量;
③完全反应后红色固体和硬质玻璃管的总质量;
④实验前干燥管质量;
⑤硬质玻璃管质量;
⑥锌粒质量;
⑦稀硫酸中含溶质的量;
⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有 、 (请写出两点).
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究.
步骤一:提出假设::
步骤二:查阅资料.得出:①+1价的铜在酸性条件下易发生自身氧化还原反应;
②在空气中灼烧氧化亚铜生成氧化铜.
步骤三:设计方案、实验.
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出.
你认为合理的方案是(填字母)
(2)乙小组针对甲小组的假设,另设计如图装置进行验证.

若按乙组装置定性检验上述红色沉淀成分,可根据
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量
①通入氢气的体积;
②反应前红色沉淀和硬质玻管的总质量;
③完全反应后红色固体和硬质玻璃管的总质量;
④实验前干燥管质量;
⑤硬质玻璃管质量;
⑥锌粒质量;
⑦稀硫酸中含溶质的量;
⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有
分析:(1)步骤一,假设:紧紧围绕“红色”来猜想,因为铜也是红色的,所以红色沉淀可能是Cu、Cu2O或者二者混合物;
方案A:于Cu、Cu2O都能与稀硝酸反应,进行分析;
方案B:Cu2O与稀硫酸反应有Cu生成,有残渣,Cu不与稀硫酸反应有残渣,进行解答;
方案C:铜在空气中灼烧生成CuO,Cu2O在空气中灼烧也生成氧化铜,但两者增加的质量不同;用极值法进行分析解答;
方案D:酸化的硝酸银溶液相当于稀硝酸,铜无法与银离子反应;
(2)锌和稀硫酸反应生成氢气,通过玻璃管能发生反应生成水和红色铜,无水硫酸铜变蓝证明生成水,证明氢气还原的是氧化亚铜固体;
解答此题时,应知道测定的原理;用此装置测定物质组成通常在如下两种途径:
氢气与Cu2O反应的化学方程式为:Cu2O+H2
2Cu+H2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu2O中O的质量,通过氧的质量可求出Cu2O的质量,再进一步判断是否含有Cu;一般不用测氢气的体积、锌粒、稀硫酸中溶质的方法,因为在用氢气还原金属氧化物时,通常需要先通一段时间氢气,反应后还要再通一段时间氢气,再加上氢气并不都能与金属氧化物反应,部分氢气会白白浪费掉,所以实际参加反应氢气的量很难测定;
该实验装置中距实际可行性方面存在的缺陷从发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽,外界空气中的水蒸气也会被无水硫酸铜吸收等考虑.
方案A:于Cu、Cu2O都能与稀硝酸反应,进行分析;
方案B:Cu2O与稀硫酸反应有Cu生成,有残渣,Cu不与稀硫酸反应有残渣,进行解答;
方案C:铜在空气中灼烧生成CuO,Cu2O在空气中灼烧也生成氧化铜,但两者增加的质量不同;用极值法进行分析解答;
方案D:酸化的硝酸银溶液相当于稀硝酸,铜无法与银离子反应;
(2)锌和稀硫酸反应生成氢气,通过玻璃管能发生反应生成水和红色铜,无水硫酸铜变蓝证明生成水,证明氢气还原的是氧化亚铜固体;
解答此题时,应知道测定的原理;用此装置测定物质组成通常在如下两种途径:
氢气与Cu2O反应的化学方程式为:Cu2O+H2
| ||
该实验装置中距实际可行性方面存在的缺陷从发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽,外界空气中的水蒸气也会被无水硫酸铜吸收等考虑.
解答:解:(1)步骤一、紧紧围绕“红色”来猜想,因为铜也是红色的,所以红色沉淀可能是Cu、Cu2O或者二者混合物,假设①:红色沉淀成分为Cu;假设②:红色沉淀成分为Cu2O;假设③:红色沉淀成分为Cu和Cu2O,
故答案为:假设①:红色沉淀成分为Cu,假设②:红色沉淀成分为Cu2O,假设③:红色沉淀成分为Cu和Cu2O;
步骤三、方案A:由于Cu、Cu2O都能与稀硝酸反应,得到蓝色溶液,所以方案A不行;
方案B:Cu2O与稀硫酸反应有Cu生成,有残渣,Cu不与稀硫酸反应有残渣,所以方案B不行;
方案C:铜在空气中灼烧生成CuO,Cu2O在空气中灼烧也生成氧化铜,但两者增加的质量不同.
agCu在空气中灼烧,完全反应后质量变为
ag,agCu2O在空气中灼烧,完全反应后质量变为
ag,所以ag红色沉淀在空气中灼烧完全反应后,当b为
ag时红色沉淀Cu;当b为
ag,时红色沉淀 Cu2O;当
a g<b<
a g,时红色沉淀为两者混合物,所以方案C合理,
方案D:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,铜和稀硝酸反应,铜无法与银离子反应,所以方案D不行;
故答案为:C;
(2)若按乙组装置定性检验上述红色沉淀成分,锌和稀硫酸反应生成氢气,通过玻璃管能发生反应生成水和红色铜,无水硫酸铜变蓝证明生成水,证明氢气还原的是氧化亚铜固体;
若按乙组装置定量测定上述红色沉淀的成分,氢气与Cu2O反应的化学方程式为:Cu2O+H2
2Cu+H2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu2O中O的质量,通过氧的质量可求出Cu2O的质量,再进一步判断是否含有Cu;一般不用测氢气的体积、锌粒、稀硫酸中溶质的方法,因为在用氢气还原金属氧化物时,通常需要先通一段时间氢气,反应后还要再通一段时间氢气,再加上氢气并不都能与金属氧化物反应,部分氢气会白白浪费掉,所以实际参加反应氢气的量很难测定,此法需要测定的数据:②③⑤,
该实验装置中距实际可行性方面存在的缺陷,发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收;
故答案为:硬质玻管中有水生成或干燥管内白色粉末变蓝;②③⑤;发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收.
故答案为:假设①:红色沉淀成分为Cu,假设②:红色沉淀成分为Cu2O,假设③:红色沉淀成分为Cu和Cu2O;
步骤三、方案A:由于Cu、Cu2O都能与稀硝酸反应,得到蓝色溶液,所以方案A不行;
方案B:Cu2O与稀硫酸反应有Cu生成,有残渣,Cu不与稀硫酸反应有残渣,所以方案B不行;
方案C:铜在空气中灼烧生成CuO,Cu2O在空气中灼烧也生成氧化铜,但两者增加的质量不同.
agCu在空气中灼烧,完全反应后质量变为
| 5 |
| 4 |
| 10 |
| 9 |
| 5 |
| 4 |
| 10 |
| 9 |
| 10 |
| 9 |
| 5 |
| 4 |
方案D:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,铜和稀硝酸反应,铜无法与银离子反应,所以方案D不行;
故答案为:C;
(2)若按乙组装置定性检验上述红色沉淀成分,锌和稀硫酸反应生成氢气,通过玻璃管能发生反应生成水和红色铜,无水硫酸铜变蓝证明生成水,证明氢气还原的是氧化亚铜固体;
若按乙组装置定量测定上述红色沉淀的成分,氢气与Cu2O反应的化学方程式为:Cu2O+H2
| ||
该实验装置中距实际可行性方面存在的缺陷,发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收;
故答案为:硬质玻管中有水生成或干燥管内白色粉末变蓝;②③⑤;发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收.
点评:本题主要考查了一些实验操作,物质性质的分析应用,掌握实验的原理及正确的操作是解题的关键,题目难度中等.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
【小题1】 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质 |
| C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质 |
| D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。 |
【小题2】 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____ ____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________ ③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________ ④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________
【小题3】某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
