题目内容
将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s) Ag2O(s)+SO3(g) ,2 SO3(g)
Ag2O(s)+SO3(g) ,2 SO3(g) 2 SO2(g)+O2(g)。反应经过10 min达到平衡,测得c(SO3)=0.4 mol/L、c(SO2)=0.1 mol/L,则下列叙述中不正确的是
2 SO2(g)+O2(g)。反应经过10 min达到平衡,测得c(SO3)=0.4 mol/L、c(SO2)=0.1 mol/L,则下列叙述中不正确的是
A、容器里气体的密度为40 g/L
B、SO3的分解率为20%
C、在这10 min内的平均速率为υ(O2)=0.005 mol•L-1•min-1
D、化学反应速率:υ(Ag2SO4)=υ(SO3)
【答案】
D
【解析】混合气中c(SO3)=0.4 mol/L、c(SO2)=0.1 mol/L,则氧气就是0.05mol/L,所以混合气的密度是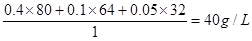 ,选项A正确;c(SO2)=0.1 mol/L,则消耗三氧化硫就是0.1mol/L,所以三氧化硫的分解率是0.1÷0.5=0.2,即20%,选项B正确;氧气在这10 min内的平均速率为υ(O2)=0.05mol/L÷10min=0.005 mol•L-1•min-1,选项C正确;硫酸银是固体,不能表示反应速率,选项D不正确,答案选D。
,选项A正确;c(SO2)=0.1 mol/L,则消耗三氧化硫就是0.1mol/L,所以三氧化硫的分解率是0.1÷0.5=0.2,即20%,选项B正确;氧气在这10 min内的平均速率为υ(O2)=0.05mol/L÷10min=0.005 mol•L-1•min-1,选项C正确;硫酸银是固体,不能表示反应速率,选项D不正确,答案选D。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
 现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验:
现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验: 回答下列问题:
回答下列问题: