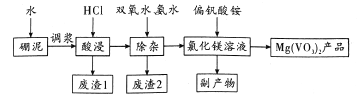
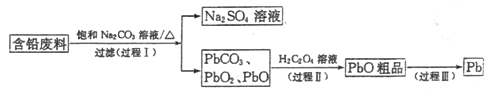
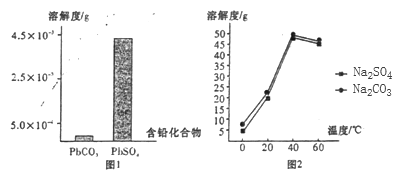
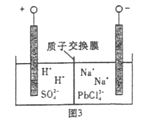
题目内容
【题目】有一包白色粉末A,由CuSO4、CaCO3、BaCl2、Na2SO4、 NaOH中的两种或两种以上的物质混合而成,为探究其组成,进行如下实验(实验流程如图):

(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C,由此可判断,原白色粉末中一定不含有_____________。
(2)向白色沉淀B中加入一定量稀盐酸,沉淀全部溶解,并产生无色气体,由此可判断,原白色粉末中一定含有_________。
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此判断,原白色粉末中一定还含有________。
(4)若流程图中无色滤液E中只含一种溶质,则无色滤液E中的溶质为______。
【答案】 CuSO4 CaCO3 NaOH、BaCl2 NaCl
【解析】(1)、因所得滤液为无色滤液,而Cu2+让溶液呈蓝色,所以无CuSO4。
(2)、实验中生成的白色沉淀可能是CaCO3,也可能是硫酸钠和氯化钡生成的硫酸钡沉淀,因白色沉淀在稀盐酸中全部溶解并产生无色气体,而硫酸钡不溶于稀盐酸,则氯化钡和硫酸钠最多只能含有一种,沉淀不是硫酸钡,所以根据CaCO3+2HCl=CaCl2+H2O+CO2↑,则一定含有CaCO3。
(3)、向无色滤液C中通入二氧化碳能够得到白色沉淀D,说明滤液C中含有BaCl2和NaOH,如果含有BaCl2,则一定不含有硫酸钠;NaOH和CO2反应生成Na2CO3和H2O,Na2CO3和BaCl2反应生成白色沉淀BaCO3,所以原白色粉末中还一定含有BaCl2和NaOH。
(4)、因NaOH和CO2反应生成Na2CO3和H2O,Na2CO3和BaCl2反应生成BaCO3沉淀和NaCl,所以若无色滤液E中只含有一种溶质,则E应为NaCl。

 阅读快车系列答案
阅读快车系列答案