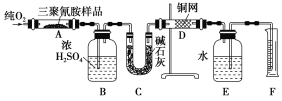
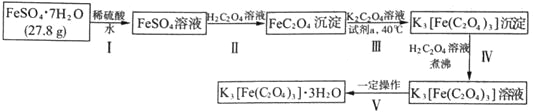
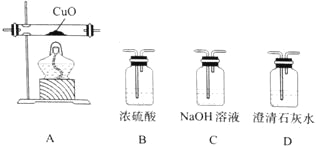
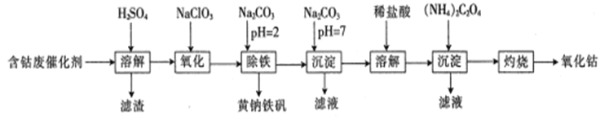
题目内容
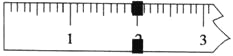
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。
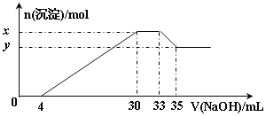
下列叙述不正确的是( )
A.原溶液中c(Cl-)=0.75 mol·L-1
B.x与y的差值为0.01 mol
C.原溶液的pH=1
D.原溶液中n(Mg2+):n(Al3+)=10:1
【答案】AD
【解析】
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=![]() =0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=
=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=![]() =0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,则c(Mg2+)=
=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,则c(Mg2+)=![]() =0.25mol/L,c(Al3+)=
=0.25mol/L,c(Al3+)=![]() =0.05mol/L,溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,以此解答该题。
=0.05mol/L,溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,以此解答该题。
A. 由以上分析可知原来溶液中c(Cl-)=0.825mol/L,故A错误;
B.由以上分析可知,x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.05mol/L×0.2L=0.01mol,故B正确;
C.c(H+)=![]() =0.1mol/L,pH=1,故C正确;
=0.1mol/L,pH=1,故C正确;
D.通过以上分析知,c(Mg2+)=0.25mol/L,c(Al3+)=0.05mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.25mol/L:0.05mol/L=5:1,故D错误;
故答案为AD。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.25 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.25 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。(注意:只要求用原始数据写表达式,不需要化简与计算)
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、电子天平、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理