��Ŀ����
��14�֣��о�NO2��SO2��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
��1��I2O5��ʹH2S��CO��HC1�������������ڶ����ⶨCO�ĺ�������֪��
2I2(s) + 5O2(g)= 2I2O5(s) ��H=��75.56 kJ��mol��1
2CO(g) + O2(g)= 2CO2(g) ��H=��566.0 kJ��mol��1
д��CO(g)��I2O5(s)��Ӧ����I2(s)��CO2(g)���Ȼ�ѧ����ʽ�� ��
��2��һ�������£�NO2��SO2��Ӧ����SO3��NO�������塣�������Ϊ1��2��NO2��SO2���������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1 mol SO2��ͬʱ����1 molNO
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K�� ��
��3�����Ͱ��������������Ļ�ѧԭ���Dz��ð�ˮ���������е�SO2������һ�������������������ղ��ﷴӦ���ü������ŵ�����ܻ�������SO2�⣬���ܵõ�һ�ָ��Ϸ��ϣ��ø��Ϸ��Ͽ��ܵĻ�ѧʽΪ ��д��һ�ּ��ɣ���
��4����ͼ��һ��̼����ȼ�ϵ�أ�MCFC������ˮú����CO��H2��Ϊȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʡ�д��B���缫��Ӧʽ ��
��5����ҵ�ϳ���Na2CO3��Һ���շ����������������NO��NO2�Ļ����Ϊ������
��֪��NO������Na2CO3��Һ��Ӧ��
NO + NO2 + Na2CO3 =2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2+ NaNO3 + CO2
����������Na2CO3��Һ��ȫ����NO��NO2�Ļ���ÿ����22.4L����״����CO2��ȫ���ݳ���ʱ������Һ����������44g������������NO��NO2�������Ϊ ��
����Na2CO3��Һ���շ�����������������ڵ�ȱ���� ��
��14�֣���ÿ��2�֣�
��1��5CO(g) +I2O5(s)=5CO2(g) + I2(s) ��H=��1377.22kJ��mol��1
��2��b��2.67��8/3
��3��(NH4)3PO4��(NH4)2HPO4��NH4H2PO4
��4��O2+ 4e��+2CO2 = 2CO32��
��5����1��7
�ڶ��ں�NO�϶�����������ȫ���գ���ΪNO������Na2CO3��Һ��Ӧ
����:��˵����ӦNO2+SO2SO3+NO�ﵽƽ��״̬��ѹǿ���䲻��Ϊ�ж����ݣ�SO3��NO������ȱ��ֲ��䲻������Ϊ�жϵ����ݡ�ÿ����1 mol SO2��ͬʱ����1 molNO��ƽ��״̬�ı�־��ƽ�ⳣ��K=0.82/0.5��1.25=2.67.��������Na2CO3��Һ��ȫ����NO��NO2�Ļ���ÿ����22.4L����״����CO2��ȫ���ݳ���ʱ������Һ����������44g
NO + NO2 + Na2CO3= 2NaNO2 + CO2
X X X
2NO2 + Na2CO3= NaNO2 + NaNO3 + CO2
Y 0.5y
X+0.5Y=1 /28X+46(X+Y)---44(X+0.5Y)=44 X=1 Y=6

 ��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮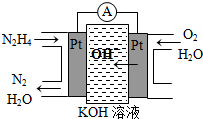 ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������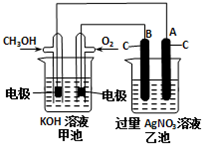 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮