题目内容
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)利用反应6NO2+8NH3
| 催化剂 | 加热 |
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
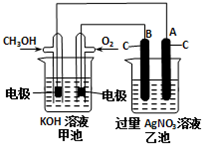
(3)CO可用于合成甲醇,某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.请回答:
①通入O2的电极名称是
②通入CH3OH的电极的电极反应式是
分析:(1)根据化合价的变化结合方程式计算;
(2)利用盖斯定律计算反应热;
(3)燃料电池的负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,和电源的正极相连的是阳极,该极上发生氧化反应,和电源负极相连的是阴极,该极上发生还原反应.
(2)利用盖斯定律计算反应热;
(3)燃料电池的负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,和电源的正极相连的是阳极,该极上发生氧化反应,和电源负极相连的是阴极,该极上发生还原反应.
解答:解:(1)反应6NO2+8NH3
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,生成7mol氮气转移24mol电子,所以当转移1.2mol电子时,生成氮气体积为
×22.4=7.84L,
故答案为:7.84;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,利用盖斯定律将①×
-②×
得NO2(g)+SO2(g)?SO3(g)+NO(g)△H=
×(-196.6kJ?mol-1)-
×(-113.0kJ?mol-1)=-41.8kJ?mol-1,
故答案为:-41.8;
(3)①通入O2的电极名称是正即极,所以B是阳极,
故答案为;正;阳;
②燃料电池的负极上是燃料发生失电子的氧化反应,即CH3OH+8OH-+6e-=CO32-+6H2O,在阴极A极上是银离子发生得电子的还原反应,即Ag++e-=Ag,
故答案为:CH3OH+8OH-+6e-=CO32-+6H2O;Ag++e-=Ag.
| ||
| △ |
| 1.2×7 |
| 24 |
故答案为:7.84;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,利用盖斯定律将①×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-41.8;
(3)①通入O2的电极名称是正即极,所以B是阳极,
故答案为;正;阳;
②燃料电池的负极上是燃料发生失电子的氧化反应,即CH3OH+8OH-+6e-=CO32-+6H2O,在阴极A极上是银离子发生得电子的还原反应,即Ag++e-=Ag,
故答案为:CH3OH+8OH-+6e-=CO32-+6H2O;Ag++e-=Ag.
点评:本题是一道关于热化学和电化学综合知识题目,要求学生注意知识的迁移和应用,难度不大.

练习册系列答案
相关题目
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.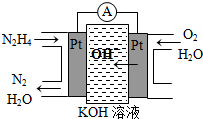 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题