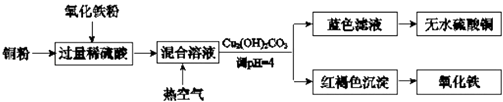
题目内容
【题目】根据元素在周期表中的位置能推测元素的原子结构以及相关物质的性质。下图是元素周期表的一部分,请根据图中字母所示元素的位置回答问题。

(1)元素W在周期表中所处的位置是______________;元素P的原子结构示意图为__________; :元素Y的最高价氧化物的电子式为________________。
(2)元素M和N的单质中还原性较强的是_________(填元素符号,下同):元素Y、Z、W的非金属性由强到弱的顺序为_______________。
(3)元素Z、N、T形成的简单离子中,半径由大到小的顺序为____________(填离子符号)。
(4)下列说法中,正确的有______________。
①元素Y的单质有多种同素异形体②M2Z中仅含离子键,M2Z2中仅含共价键
③X2T和M2Z都是离子化合物 ④X2Z比X2T的沸点更高
(5)X、Z、M、T可形成含Z原子个数不同的两种常见酸式盐(均含四种元素),这两种酸式盐在溶液中相互反应的离子方程式为____________________。
【答案】 第三周期、第IVA族 
![]() Na O>C>Si r(S2-)>r(O2-)>r(Al3+)(写S2->O2->Al3+也给分) ①④ HSO3-+H+=SO2↑+ H2O(写HSO3-+ HSO4-= SO2↑+SO32-+H2O也给分)
Na O>C>Si r(S2-)>r(O2-)>r(Al3+)(写S2->O2->Al3+也给分) ①④ HSO3-+H+=SO2↑+ H2O(写HSO3-+ HSO4-= SO2↑+SO32-+H2O也给分)
【解析】本题主要考查元素周期表与元素周期律。由元素在元素周期表中的位置可以判断X、Y、Z、M、N、W、T、P分别是氢、碳、氧、钠、铝、硅、硫、钙。
(1)元素W在周期表中所处的位置是第三周期、第IVA族;元素P的原子结构示意图为 ;元素Y的最高价氧化物是二氧化碳,其电子式为
;元素Y的最高价氧化物是二氧化碳,其电子式为![]() 。
。
(2)元素M和N的单质中还原性较强的是Na:元素Y、Z、W的非金属性由强到弱的顺序为O>C>Si。
(3)电子层结构相同离子的半径随着核电荷数增大而减小,所以r(O2-)>r(Al3+),同主族元素离子半径随着电子层数增大而增大,所以r(S2-)>r(O2-),总之,r(S2-)>r(O2-)>r(Al3+)。
(4)①元素Y的单质有金刚石、石墨、足球烯等多种同素异形体,故①正确;②M2Z2中还含离子键,故②错误;③X2T是共价化合物,故③错误;④水分子之间存在氢键,所以X2Z比X2T的沸点更高,故④正确。故选①④。
(5)这两种酸式盐分别是亚硫酸氢钠和硫酸氢钠,它们在溶液中相互反应的离子方程式为HSO3-+H+=SO2↑+ H2O。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案