题目内容
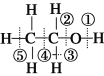
【题目】蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下面是爱迪生电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列有关爱迪生电池的推断不正确的是
Fe(OH)2+Ni(OH)2,下列有关爱迪生电池的推断不正确的是
A. 放电时,Fe是负极,NiO2是正极
B. 蓄电池的电极可以浸入某种酸性电解质溶液中
C. 充电时,阴极上的电极反应为:Fe(OH)2 + 2e-= Fe + 2OH-
D. 放电时,电解质溶液中的阴离子向负极方向移动
【答案】B
【解析】
放电时,Fe被氧化生成Fe(OH)2,电极反应式为Fe-2e-+2OH-=Fe(OH)2,正极NiO2得电子被还原生成Ni(OH)2,电极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-,充电时,阴极、阴极与正负极反应正好相反,据此分析解答。
A.放电时,Fe是负极,发生氧化反应,NiO2是正极,发生还原反应,故A正确;B.放电时能生成Fe(OH)2、Ni(OH)2,这两种物质能溶于酸,不能溶于碱,所以电解质溶液应该呈碱性,故B错误;C.充电时,阴极上电极反应式与正极反应式正好相反,所以电极反应式为Fe(OH)2+2e-═Fe+2OH-,故C正确;D.放电时,电解质溶液中阴离子向负极移动,故D正确;故选B。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
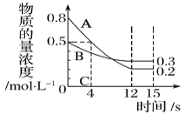
(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为_______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大______(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_____________ 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是________。
2HI(g)已达平衡状态的是________。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)