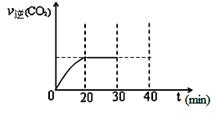
题目内容
下列离子方程式书写正确的是:
| A.碳酸氢镁溶液中加入过量的NaOH溶液:Mg2++2HCO3-十4OH一=Mg(OH)2 ↓2H2O+2CO32— |
| B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
C.少量C12通入水中:Cl2 +H2O 2H++C1O-十C1- 2H++C1O-十C1- |
| D.酸性高锰酸钾可使草酸溶液褪色:2MnO4-+5C2O42-+16H+= 2Mn2++ l0CO2 ↑+8H2O |
A
试题分析:A、碳酸氢镁完全电离产生Mg2+、2HCO3-,二者都可与NaOH反应,所以离子方程式为Mg2++2HCO3-十4OH一=Mg(OH)2 ↓2H2O+2CO32—,正确;B、Ba(OH)2完全电离产生Ba2+、2OH-,而所给方程式中只用掉1个OH-,说明溶液中仍存在OH-,则溶液显碱性,与已知矛盾,错误;C、C12与水反应生成的次氯酸是弱酸,不能拆开,错误;D、草酸是弱酸,不能拆开,错误,答案选A。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: