题目内容
(6分)⑴已知X、Y元素可形成XY2型化合物,XY2中具有38个电子,若XY2是离子化合物,其化学式为____________,若XY2为共价化合物,其化学式为____________
⑵已知第2周期中A、B两元素原子序数之差为2,用电子式表示它们形成化合物AB2的过程________________________________。。
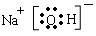
⑶已知1mol某物质含有不同短周期的三种元素的原子各1mol,其质子总物质的量为20mol,
该物质的电子式为________________
⑷已知X元素的最高正价与负价绝对值之差为6,Y元素和X原子的次外层都有8个电子,X、
Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则X、Y所形成化合物过程的电子式可能为________________或________________
⑵已知第2周期中A、B两元素原子序数之差为2,用电子式表示它们形成化合物AB2的过程________________________________。。
⑶已知1mol某物质含有不同短周期的三种元素的原子各1mol,其质子总物质的量为20mol,
该物质的电子式为________________
⑷已知X元素的最高正价与负价绝对值之差为6,Y元素和X原子的次外层都有8个电子,X、
Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则X、Y所形成化合物过程的电子式可能为________________或________________
(每空1分)(1)CaF2 ,CS2(BeC12)
(2)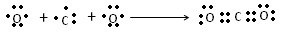
(3)
(4)

(2)
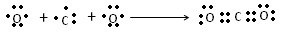
(3)

(4)


(1)由化学式XY2可大致判定两元素为IIA、VIIA族元素或IVA或VIA族元素;具体为:BeCl2、CaF2、CS2。离子化合物为:CaF2,共价化合物为:CS2(BeC12)。
(2)结合AB2的元素化合物价及原子序数可综合判断出该化合物为CO2:
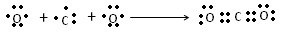
(3)三元素中一定有H元素,则对第二周期、第三周期元素进行排列组合(比如第三周期第一元素为Na,质子数为11,则第二周期元素质子数必为8,即O元素)很容易得出该物质为NaOH:
(4)X元素为第VIIA族元素,次外层为8个电子,则Cl元素,对应的Y元素可能为K、Ca元素:
KCl:
CaCl2:
(2)结合AB2的元素化合物价及原子序数可综合判断出该化合物为CO2:
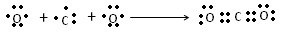
(3)三元素中一定有H元素,则对第二周期、第三周期元素进行排列组合(比如第三周期第一元素为Na,质子数为11,则第二周期元素质子数必为8,即O元素)很容易得出该物质为NaOH:

(4)X元素为第VIIA族元素,次外层为8个电子,则Cl元素,对应的Y元素可能为K、Ca元素:
KCl:

CaCl2:


练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目