题目内容
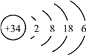
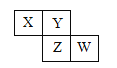
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
A. Y单质与氢气反应较Z缓和
B. 最高价氧化物对应水化物酸性W比Z强
C. X单质氧化性强于Y单质
D. X与W的原子核外电子数相差9
【答案】B
【解析】
X、Y、Z、W均为短周期元素,由元素相对位置可知,X和Y处于第二周期,Z和W处于第三周期,若Z原子的最外层电子数是第一层电子数的3倍,第一层电子数为2,则Z元素最外层电子数是6,所以Z是S元素,可推知W为Cl元素,Y是O元素,X是N元素,结合元素周期律来分析解答。
X、Y、Z、W均为短周期元素,由元素相对位置可知,X和Y处于第二周期,Z和W处于第三周期,若Z原子的最外层电子数是第一层电子数的3倍,第一层电子数为2,则Z元素最外层电子数是6,所以Z是S元素,可推知W为Cl元素,Y是O元素,X是N元素。
A.非金属性Y(O)>Z(S),所以Y的单质与氢气反应较Z剧烈,选项A错误;
B.非金属性W(Cl)>Z(S),所以最高价氧化物对应水化物的酸性W比Z强,选项B正确;
C.X为N元素、Y为O元素,氧元素非金属性较强,故氮气的氧化性小于氧气,选项C错误;
D.X为N元素、W为Cl元素,二者原子核外电子数相差17﹣7=10,选项D错误。
答案选B。

【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.010mol·L-1氨水 | 用量筒量取10.0mL5.00mol·L-1氨水于烧杯中,加入少量蒸馏水稀释,转移至500 mL容量瓶中定容 |
B | 探究SO2的还原性 | 向盛有2mLH2S溶液的试管中缓慢通入SO2,观察是否有沉淀生成 |
C | 制取并纯化溴苯 | 向FeBr3固体中慢慢加入Br2的苯溶液,充分反应后经水洗、Na2SO3溶液洗、水洗、分液、干燥,然后蒸馏 |
D | 比较两种黑色固体FeS和CuS的溶度积 | 向物质的量浓度相同的FeCl2和CuCl2的混合溶液中不断加入Na2S溶液,观察沉淀颜色 |
A. A B. B C. C D. D