题目内容
【题目】有Al2(SO4)3和K2SO4的混合溶液200mL,将它均分成两份。一份滴加足量氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO42﹣完全沉淀。反应中消耗a mol NH3H2O、b mol BaCl2.据此得知原混合溶液中的c(K+)为( )
A. (20b﹣10a)molL﹣1B. ![]() molL﹣1
molL﹣1
C. (10b﹣5a)molL﹣1D. ![]() molL﹣1
molL﹣1
【答案】A
【解析】
第一份发生的离子反应方程式为Al3++3NH3·H3O=Al(OH)3↓+3NH4+,第二份发生的离子反应方程式为Ba2++SO42-=BaSO4↓。
由反应消耗a mol NH3·H2O可知,原溶液中n(Al3+)=![]() mol,由消耗bmolBaCl2可知,n(SO42-)=2bmol,原溶液中存在电荷守恒关系n(K+)+3n(Al3+)=2n(SO42-),溶液中n(K+)=2n(SO42-)—3n(Al3+)=4b—3×
mol,由消耗bmolBaCl2可知,n(SO42-)=2bmol,原溶液中存在电荷守恒关系n(K+)+3n(Al3+)=2n(SO42-),溶液中n(K+)=2n(SO42-)—3n(Al3+)=4b—3×![]() =4b—2a,则c(K+)=
=4b—2a,则c(K+)=![]() =(20b﹣10a)molL﹣1,故选A。
=(20b﹣10a)molL﹣1,故选A。

【题目】下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④
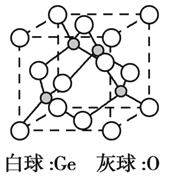
【题目】锗是重要的半导体材料之一。碳、硅、锗位于同主族。
(1)基态锗原子的价层电子排布式为__________________。
(2)几种晶体的熔点和硬度如表所示。
晶体 | 金刚石 | 碳化硅 | 二氧化硅 | 硅 | 锗 |
熔点/℃ | 3 550 | 2 700 | 1 710 | 1 410 | 1 211 |
硬度 | 10 | 9.5 | 7 | 6.5 | 6.0 |
①碳化硅的晶体类型是__________________。
②二氧化硅的熔点很高,而干冰(固体二氧化碳)易升华,其主要原因是__________________。
③硅的熔点高于锗的,其主要原因是___________________________。
(3)![]() 的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
(4)1个CS2分子中含_________个π键。
(5)锗的氧化物晶胞如图所示。已知:该氧化物的摩尔质量为M g·mol1,NA代表阿伏加德罗常数的值,晶胞密度为 ρ g·cm3。该晶胞的化学式为_________。氧原子的配位数为_________。该晶胞参数为_________cm(用代数式表示)。
 。
。











