题目内容
【题目】(一)某溶液由Na+、CO32-、SO42-、Ca2+、Cl- 中的几种离子组成,现进行如下实验:
①取5mL待测液分成两份;
②第一份滴加BaCl2溶液,有白色沉淀产生,再加过量稀HNO3,沉淀全部溶解;
③第二份滴加AgNO3溶液,有白色沉淀产生,再加过量稀HNO3,沉淀部分溶解,同时有无色无味的气体产生。
回答下列问题:
(1)该溶液中一定含有的离子有_________________;一定不含有的离子有____________________。
(2)写出②中白色沉淀溶解的离子方程式___________________________________。
(二)①一定温度下,向体积相同的三个密闭容器中,分别充入CH4、O2、O3,测得容器内气体密度均相同,则三个容器中气体压强之比为P(CH4):P(O2):P(O3)=_____________________。
②标准状况下,1体积的水溶解500体积的HCl气体,若所得溶液密度为1.19g/cm3,则所得盐酸溶液的物质的量浓度为_____________mol/L(保留3位有效数字)。
【答案】Na+、CO32-、Cl- SO42-、Ca2+ BaCO3+2H+=Ba2++CO2↑+H2O 6:3:2 14.6
【解析】
(1) ②第一份滴加BaCl2溶液,有白色沉淀产生,再加过量稀HNO3,沉淀全部溶解,说明溶液中含有碳酸根离子,则不含钙离子,不含硫酸根离子,一定含有钠离子;③第二份滴加AgNO3溶液,有白色沉淀产生,再加过量稀HNO3,沉淀部分溶解,同时有无色无味的气体产生,说明溶液含有氯离子。说明溶液中含有 Na+、CO32-、Cl-,一定不含SO42-、Ca2+。
(2) ②中白色沉淀为碳酸钡,溶解的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O;
(二) ①一定温度下,体积相同的三个密闭容器中,气体密度相同,则说明气体质量相同,压强比等于物质的量比,物质的量比等于摩尔质量的反比,即为1/16:1/32:1/48= 6:3:2。
②假设水的体积为1L,则500L氯化氢的物质的量为500/22.4mol,溶液的质量为1000+500×36.5/22.4g,溶液的体积为(1000+500×36.5/22.4)÷1.19mL,物质的量浓度为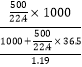 =14.6 mol/L。
=14.6 mol/L。