题目内容
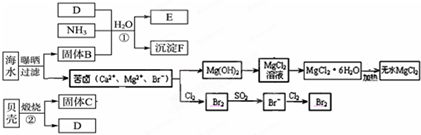
海洋是巨大的化学资源宝库.如图是海水化学资源综合利用的部分流程图:
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、 (填试剂化学式),然后 (填操作名称).在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐.
(2)制取MgCl2的过程中涉及反应:MgCl2?6H2O
MgCl2+6H2O,该反应要在HCl气流中进行,原因是 .
(3)沉淀F的化学式为 ,在进行反应①时,在固体B的溶液中是先通入D气体还是先通入NH3? .
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.在由海水提溴过程中可得出Cl-、SO2、Br-还原性由强到弱的顺序是 .

回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
(2)制取MgCl2的过程中涉及反应:MgCl2?6H2O
| ||
(3)沉淀F的化学式为
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.在由海水提溴过程中可得出Cl-、SO2、Br-还原性由强到弱的顺序是
考点:海水资源及其综合利用,氯、溴、碘及其化合物的综合应用,金属冶炼的一般原理,粗盐提纯
专题:化学应用
分析:(1)用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子、用碳酸钠溶液除去钙离子;分离不溶性固体和溶液采用过滤的方法;在溶液中加入少量稀盐酸除去杂质;
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl;
(3)在氯化钠饱和溶液中通入氨气,然后通入二氧化碳气体得到碳酸氢钠固体和氯化铵溶液;
(4)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性.
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl;
(3)在氯化钠饱和溶液中通入氨气,然后通入二氧化碳气体得到碳酸氢钠固体和氯化铵溶液;
(4)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性.
解答:
解:(1)用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,碳酸根离子和钙离子反应生成碳酸钙沉淀,所以用碳酸钠溶液除去钙离子;分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤;
在溶液中加入少量稀盐酸除去碳酸钠,盐酸具有挥发性,利用HCl的挥发性除去稀盐酸,
故答案为:Na2CO3;过滤;稀盐酸;
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl,为防止氯化镁水解,应该在HCl气流中加热氯化镁晶体,故答案为:氯化镁易水解;
(3)在氯化钠饱和溶液中通入氨气,然后通入二氧化碳气体得到碳酸氢钠固体和氯化铵溶液,氨气极易溶于水,碳酸酸性小于盐酸,二氧化碳难溶于氯化钠溶液,所以先通入氨气后通入二氧化碳,碳酸氢钠的溶解度小于氯化钠,所以有固体碳酸氢钠析出,则F为NaHCO3;
故答案为:NaHCO3;先通入氨气;
(4)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,
Cl2+2 Br-=Br2+2Cl-中还原性 Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-,故答案为:SO2>Br->Cl-.
.
在溶液中加入少量稀盐酸除去碳酸钠,盐酸具有挥发性,利用HCl的挥发性除去稀盐酸,
故答案为:Na2CO3;过滤;稀盐酸;
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl,为防止氯化镁水解,应该在HCl气流中加热氯化镁晶体,故答案为:氯化镁易水解;
(3)在氯化钠饱和溶液中通入氨气,然后通入二氧化碳气体得到碳酸氢钠固体和氯化铵溶液,氨气极易溶于水,碳酸酸性小于盐酸,二氧化碳难溶于氯化钠溶液,所以先通入氨气后通入二氧化碳,碳酸氢钠的溶解度小于氯化钠,所以有固体碳酸氢钠析出,则F为NaHCO3;
故答案为:NaHCO3;先通入氨气;
(4)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,
Cl2+2 Br-=Br2+2Cl-中还原性 Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-,故答案为:SO2>Br->Cl-.
.
点评:本题考查了海水资源的综合利用,涉及还原性强弱比较、除杂剂的选取、氯化镁的制取等知识点,根据还原性强弱比较方法、物质的性质等知识点来分析解答,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
 在我省盛大节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
在我省盛大节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、S-诱抗素分子中含有苯环 |
| B、S-诱抗素分子中只含有极性键 |
| C、S-诱抗素分子中所有原子共面 |
| D、S-诱抗素属于烃的衍生物 |
下列离子方程式中,正确的是( )
| A、向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| B、金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ |
| C、铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ |
| D、氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
不属于氧化还原反应的是( )
A、N2+3H2
| ||||
B、SiO2+CaO
| ||||
C、2Al+Fe2O3
| ||||
D、2Mg+CO2
|