题目内容
(1)在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是
(2)写出下列物质的电子式:CO2
 NaCl
NaCl
 HClO
HClO
 .
.
①
①
,只含有极性键的是④
④
,既含离子键又含非极性共价键的是⑤
⑤
.(2)写出下列物质的电子式:CO2






分析:金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,据此进行判断.
解答:解:(1)①NaCl为离子化合物,只含有离子键;
②NaOH为离子化合物,既含有离子键,又含有极性共价键;
③N2为非金属单质,只含有非极性共价键;
④H2S为共价化合物,只含有极性共价键;
⑤Na2O2为离子化合物,既含有离子键,又含有非极性共价键.
故答案为:①;④;⑤;
(2)CO2为共价化合物,电子式为 ,NaCl为离子化合物,电子式为
,NaCl为离子化合物,电子式为 ,HClO为共价化合物,电子式为
,HClO为共价化合物,电子式为 ,
,
故答案为: ;
; ;
; .
.
②NaOH为离子化合物,既含有离子键,又含有极性共价键;
③N2为非金属单质,只含有非极性共价键;
④H2S为共价化合物,只含有极性共价键;
⑤Na2O2为离子化合物,既含有离子键,又含有非极性共价键.
故答案为:①;④;⑤;
(2)CO2为共价化合物,电子式为
 ,NaCl为离子化合物,电子式为
,NaCl为离子化合物,电子式为 ,HClO为共价化合物,电子式为
,HClO为共价化合物,电子式为 ,
,故答案为:
 ;
; ;
; .
.点评:本题考查化学键的类型以及电子式的书写,题目难度不大,注意离子键与共价键的区别以及电子式的书写方法.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
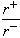 =_______________。
=_______________。 )
)