题目内容
【题目】如图所示的铜﹣锌原电池中, 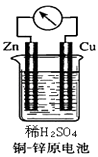
(1)原电池的电极反应式是:正极: , 负极:;
(2)若生成的氢气在标况下的体积为4.48L,则反应过程中有mol电子转移.在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率(选填“要快”、“要慢”、“相等”、“无法确定”).
(3)若根据氧化还原反应Cu+2Ag+═Cu2++2Ag 来设计原电池,则次原电池的负极材料应选 , 电解质溶液应为 .
【答案】
(1)2H++2e﹣=H2↑;Zn﹣2e﹣=Zn2+
(2)0.4;要快
(3)铜片;硝酸银溶液
【解析】解:(1)铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn﹣2e﹣=Zn2+ , 锌片逐渐溶解;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e﹣=H2↑,所以答案是:2H++2e﹣=H2↑;Zn﹣2e﹣=Zn2+;(2)若生成的氢气在标况下的体积为4.48L,及生成0.2mol氢气,有0.4mol电子转移,原电池加快反应速率;所以答案是:0.4mol;要快;(3)原电池中失电子的物质作负极,根据反应方程式知,Cu作负极,电解质溶液中含有得电子的Ag+ , 可用硝酸银溶液作电解质溶液,所以答案是:铜片;硝酸银溶液.

练习册系列答案
相关题目