题目内容
9.下列离子方程式改写成化学方程式正确的是( )| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO${\;}_{3}^{2-}$+2H+═CO2↑十H2O BaCO3+2HCl═BaCl2+C02↑十H20 | |
| C. | Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H20 CH3COOH+KOH=CH3COOK+H20 |
分析 A.沉淀反应中,生成物的溶解度越小,沉淀反应越容易发生,碳酸铜为沉淀应保留化学式;
B.碳酸钡为沉淀应保留化学式;
C.反应的实质是钙离子与碳酸根离子反应生成碳酸钙沉淀;
D.CH3COOH为弱电解质,应保留化学式.
解答 解:A.Cu(OH)2的溶解度小于CuCO3的溶解度,CuCO3+2NaOH═Cu(OH)2↓+Na2CO3则反应的离子方程式为:CuCO3+2OHˉ=CO32ˉ+Cu(OH)2↓,故A错误;
B.BaCO3+2HCl═BaCl2+C02↑+H20反应的离子方程式为:BaCO3+2H+═Ba2++C02↑+H20,故B错误;
C.Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3反应的实质是钙离子与碳酸根离子反应生成碳酸钙沉淀,离子方程式为:Ca2++CO32-═CaCO3↓,故C正确;
D.CH3COOH+KOH=CH3COOK+H20,反应的离子方程式为:CH3COOH+OH-═CH3COO-+H20,故D错误;
故选C.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子方程式书写应符合客观规律、应遵循原子个数、电荷数守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列有关说法正确的是( )
| A. | 在同温同压下,相同体积的任何气体含有相同数目的原子 | |
| B. | 氧化还原反应的本质是有电子转移 | |
| C. | Na2SO4溶液在电流作用下电离出Na+与SO42-而导电 | |
| D. | NaCl固体不导电,所以NaCl不是电解质 |
17.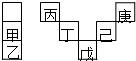 甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差27 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 丁的最高价氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
14.常温下,下列各组离子在特定溶液中一定能大量共存的是( )
| A. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Cl-、HCO3-、SO42- | |
| B. | pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- | |
| C. | 甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| D. | 加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
1.设 NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 在常温常压下,22.4 L 氧气所含的分子数目为NA | |
| B. | 44 g 二氧化碳所含的原子数目为NA | |
| C. | 18 g 水所含的电子数目为9 NA | |
| D. | 1 mol 钠作为还原剂所提供的电子数为NA |
18.下列说法不正确的是( )
| A. | 利用风能发电、采取节能技术、使用太阳能热水器均有利于减少二氧化碳排放 | |
| B. | 生活垃圾焚烧发电也会产生有毒有害物质 | |
| C. | 丁达尔现象可用于区别溶液与胶体,云、雾、淀粉溶液均能产生丁达尔现象 | |
| D. | 硅酸钠溶液的保存和碱溶液一样,存放在橡胶塞密封的广口试剂瓶中 |
19.下列关于热化学反应的描述中正确的是( )
| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ•mol-1 | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ•mol-1 | |
| C. | 有气体参加的化学反应,增大压强,可增大活化分子百分数,从而使反应速率增大 | |
| D. | 在101Kpa时,物质完全燃烧生成稳定氧化物时所放出的热量,叫做该物质的燃烧热 |
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.