题目内容
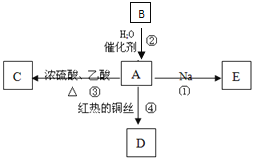
【题目】A是常见的有机物质,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如图甲所示,请回答下列问题:
![]()
(1)B的结构式为____________。D物质的名称是_________。
(2)在①~④反应中,属于加成反应的是______________(填反应序号);
(3)写出反应④的化学方程式:________________________。
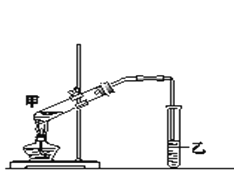
(4)实验室用图乙所示装置进行反应③
a.反应③的化学方程式是___________.反应类型为______。
b.乙中的导管不能伸入到液面下的原因是__________________。
c.实验完成后,从试管乙中分离出有机物C的方法是_____________。
【答案】 ![]() 乙醛 ② 2C2H5OH+O2
乙醛 ② 2C2H5OH+O2![]() 2CH3CHO+2H2O C2H5OH+CH3COOH
2CH3CHO+2H2O C2H5OH+CH3COOH![]() CH3COOC2H5+H2O 取代反应 防止倒吸 振荡、静止、分液
CH3COOC2H5+H2O 取代反应 防止倒吸 振荡、静止、分液
【解析】B的产量可衡量一个国家石油化工发展的水平,B是乙烯,A是常见的有机物质,它易溶于水并有特殊香味,乙烯与水反应生成A,所以A是乙醇。乙醇和钠反应生成乙醇钠和氢气,E是乙醇钠。乙醇发生催化氧化生成乙醛,D是乙醛。乙醇和乙酸发生酯化反应生成乙酸乙酯,C是乙酸乙酯。则
(1)B是乙烯,结构式为![]() 。D物质的名称是乙醛。(2)根据以上分析可知在①~④反应中,属于加成反应的是②;(3)反应④的化学方程式为2C2H5OH+O2
。D物质的名称是乙醛。(2)根据以上分析可知在①~④反应中,属于加成反应的是②;(3)反应④的化学方程式为2C2H5OH+O2![]() 2CH3CHO+2H2O:(4)a.反应③是酯化反应,反应的化学方程式是C2H5OH+CH3COOH
2CH3CHO+2H2O:(4)a.反应③是酯化反应,反应的化学方程式是C2H5OH+CH3COOH![]() CH3COOC2H5+H2O。b.由于生成的乙酸乙酯中含有乙酸和乙醇,二者均与水互溶,所以乙中的导管不能伸入到液面下的原因是防止倒吸。c.乙酸乙酯不溶于水,所以实验完成后,从试管乙中分离出有机物C的方法是振荡、静止、分液。
CH3COOC2H5+H2O。b.由于生成的乙酸乙酯中含有乙酸和乙醇,二者均与水互溶,所以乙中的导管不能伸入到液面下的原因是防止倒吸。c.乙酸乙酯不溶于水,所以实验完成后,从试管乙中分离出有机物C的方法是振荡、静止、分液。

 计算高手系列答案
计算高手系列答案【题目】根据题意解答
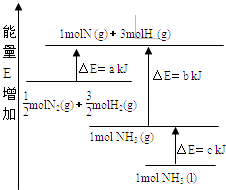
(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1),请回答下列问题: 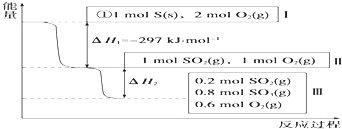
①写出能表示硫的燃烧热的热化学方程式: .
②在相同条件下,充入1mol SO3和0.5mol 的O2 , 则达到平衡时SO3的转化率为;此时该反应(填“放出”或“吸收”)KJ的能量.
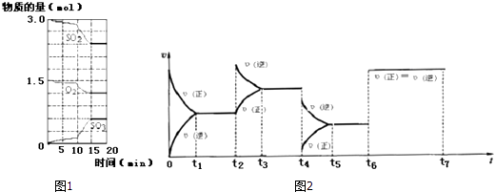
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=molL﹣1min﹣1 . 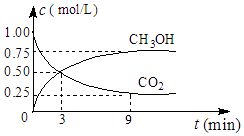
②能说明上述反应达到平衡状态的是(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2 , 同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
【题目】在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)![]() 2C(g);△H>0 。达到平衡后,改变一个条件(x),下列量(y)一定符合右图中曲线的是( )
2C(g);△H>0 。达到平衡后,改变一个条件(x),下列量(y)一定符合右图中曲线的是( )

x | y | |
A | 再加入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
A. A B. B C. C D. D
【题目】下列关于有机物实验现象与原因的叙述中,完全正确的一组是( )
选项 | 实验现象 | 原因 |
A | 乙烯和苯都能使溴水褪色 | 乙烯和苯都能与溴水发生加成反应 |
B | 乙酸与NaHCO3溶液反应产生无色气体 | 乙酸的酸性比碳酸强 |
C | 葡萄糖和蔗糖都能与银氨溶液共热产生银镜 | 葡萄糖和蔗糖都有醛基 |
D | 乙醇和钠反应剧烈 | 乙醇羟基中的氢原子活泼 |
A. A B. B C. C D. D