题目内容
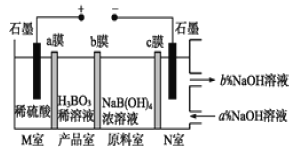
【题目】现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是
A.M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B.产品室发生的反应是:B(OH)4-+H+![]() H3BO3+H2O
H3BO3+H2O
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.b膜为阴离子交换膜
【答案】C
【解析】
与电源正极相连的石墨电极为阳极,H2O失电子生成H+和O2,H+通过a膜进入产品室,则a膜为阳膜;与电源负极相连的石墨电极为阴极,H2O得电子生成H2和OH-,从NaOH溶液的流向看,其浓度应增大,所以Na+通过c膜流向N室,c膜为阳膜;B(OH)4-通过b膜流向产品室,则b膜为阴膜。
A. 通过以上分析可知,M室H2O失电子生成H+和O2,则发生的电极反应式为:2H2O-4e-=O2↑+4H+,A正确;
B. 产品室中,通过a膜进入的H+与通过b膜进入的B(OH)4-发生反应,B(OH)4-+H+![]() H3BO3+H2O,B正确;
H3BO3+H2O,B正确;
C. 理论上每生成1 mol H3BO3,通过b膜的B(OH)4-为1mol,通过c膜的Na+为1mol,则生成OH-为1mol,N室电极反应式为2H2O+2e-=2OH-+H2↑,从而得出阴极室可生成H2 0.5mol,标准状况下体积为11.2 L,C不正确;
D. 由以上分析可知,b膜为阴离子交换膜,D正确;
故选C。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目