题目内容
【题目】50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A. 小于0.45mo1B. 等于0.45molC. 在0.45mol和0.9mol之间D. 大于0.9mo1
【答案】A
【解析】
50mL18mol/L的硫酸中n(H2SO4)=18mol/L×0.05L=0.9mol,由Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量理论上是参加反应的硫酸的一半,但随着反应的进行,浓硫酸溶液的浓度逐渐减小,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,所以作氧化剂的硫酸的物质的量小于0.45mol,即被还原的硫酸的物质的量小于0.45mol。
CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量理论上是参加反应的硫酸的一半,但随着反应的进行,浓硫酸溶液的浓度逐渐减小,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,所以作氧化剂的硫酸的物质的量小于0.45mol,即被还原的硫酸的物质的量小于0.45mol。
故选A。

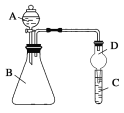
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2)]是分析化学中的重要试剂,在隔绝空气加热至500℃时能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。某化学小组选用下图所示装置进行实验(夹持装置略),探究此反应产物。
(1)甲同学根据可能生成的气体产物,设计下列实验:
操作步骤 | 实验现象 | 结论或解释 |
①按______________的顺序组装仪器并进行实验 | ②___________ | 气体产物中既有H2O ,也有NH3 |
③按A、C、D、E的顺序组装仪器并进行实验,其中装置C的作用是____________ | C中无明显现象,D中生成白色沉淀 | ④D中发生反应的离子方程式为___________ |
(2)乙同学称取14.20g硫酸亚铁铵固体,隔绝空气加热至500℃ 时使其完全分解,冷却后称得固体质量为4.00g,则所得固体产物的化学式为_____。(硫酸亚铁铵的摩尔质量为284g·mol-1)
(3)实验证明:(NH4)2Fe(SO4)2受热分解除生成上述产物外,还有N2生成,写出硫酸亚铁铵在隔绝空气的条件下加热至500℃时的分解反应方程式_____________________________________。
【题目】下面是元素周期表的一部分,请按要求填空:
A | C | ||||||||||||||||
B | D | E | |||||||||||||||
F | |||||||||||||||||
(1)A元素最高价氧化物的化学式为_______。
(2)单质A与C在放电时形成的化合物为________(填化学式)。
(3)F、E元素最高价氧化物对应的水化物酸性比较:_____(填化学式)。
(4)B在C中燃烧形成的化合物电子式:____________________。
(5)化合物FE的化学性质与卤素的性质相似,可与水发生反应生成卤化氢和次卤酸。试写出FE与水发生反应的化学方程式__________________________。
【题目】研究非元素及其化合物的性质具有重要意义。
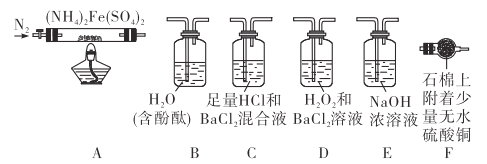
Ⅰ. 含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测定烟气中SO2的体积分数。
(一)模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为___________________________。
(2)用B装置制CO2,使用该装置优点的是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
(二)测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是__________、__________。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液 ④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数____________________。
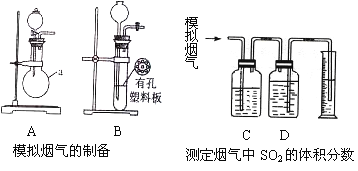
Ⅱ.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。
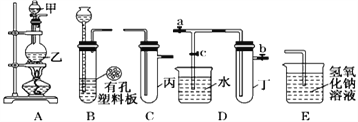
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
实验操作 | 现 象 | 结 论 |
氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。
②请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。