��Ŀ����
����Ŀ����ʵ�黯ѧ��
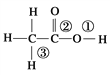
���������ƣ�Na2S2O5���dz��õĿ����������ڿ���������ʱ�ֽ⣬����ˮ������NaHSO3��ʵ�����Ʊ�����Na2S2O5�ķ��������Ʒ�Ӧ�¶���40�����ң��ڲ��Ͻ�������Na2CO3��������Һ��ͨ��SO2��ʵ��װ����ͼ��ʾ��

����ҺpHԼΪ4ʱ��ֹͣ��Ӧ����20�����Ҿ��ýᾧ�õ�Na2S2O5���塣
��1������ҺpHԼΪ4ʱ����Һ�к���Ԫ�ص�������ҪΪ ���ѧʽ�����÷�Ӧ��SO2��Na2CO3��Һ��Ӧ�����ӷ���ʽΪ ��
��2����ͬѧ��Ϊ��ʵ�����ȱ�ݣ���ȱ�ݻᵼ��ʵ����̼�ʵ������� ��
��3����������ķ�ӦҺ����ѹ���ˡ�ϴ�ӡ�25����30������ɻ��Na2S2O5���塣
����ɼ�ѹ����װ�õ���Ҫ������ ������ƿ�ͳ����á�
�������ñ���SO2ˮ��Һ����ˮ�Ҵ�ϴ��Na2S2O5���壬����ˮ�Ҵ�ϴ�ӵ�Ŀ���� ��
��4��ʵ���Ƶõ�Na2S2O5�����к���һ������Na2SO3��Na2SO4������ܵ�ԭ���� ��
���𰸡�ÿ��2��
��1��NaHSO3 2SO2+CO32��+H2O=2HSO3��+CO2��
��2�����������
��3��������©�� �������ܽ���ʧ����ȥ��������ˮ��
��4�����Ʊ�������Na2S2O5�ֽ�����Na2SO3����Na2SO3�ױ���������Na2SO4
��������
���������
��1����ʱ��ҺΪ���ԣ�����ֻ����NaHSO3��������������Ϊ���Ի���ԣ�����ͨ��Ķ�������Ϊ��������Ӧ�����ӷ���ʽΪ2SO2+CO32��+H2O=2HSO3��+CO2��
��2��������������������������Һ���������������ʵ��ȱ�ٷ�����װ�ã�
��3������ɼ�ѹ����װ�õ���Ҫ�����Dz���©��������ƿ�ͳ����ã�
��Na2S2O5������ˮ����NaHSO3���������Ҵ�ϴ�Ӵ����������ܽ���ʧ�⣬���г�ȥˮ�ֵ����á�
��4��Na2S2O5�ֽ�����Na2SO3����Na2SO3�ױ���������֪�Ƶõ�Na2S2O5�����к���һ������Na2SO3 ��Na2SO4��