题目内容
【题目】硫化钠在染料工业有着重要的用途。工业中常用煤粉(主要成分为碳)还原芒硝(Na2SO4)制备硫化钠。
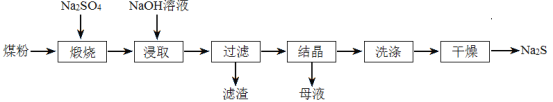
(1)①煅烧时煤粉把Na2SO4还原为Na2S,反应方程式为 。煤粉的作用是a.作为还原剂生成CO2、b. 。
②煅烧时常有副反应发生:Na2S+4CO2![]() Na2CO3+SO2+3CO
Na2CO3+SO2+3CO
4Na2S+O2![]() 2Na2S2+2Na2O
2Na2S2+2Na2O
为了控制杂质的生成可采取的措施是 。
(2)浸取用NaOH溶液而不用水的原因是 。
(3)滤渣需要用水洗涤回收,其目的是 。
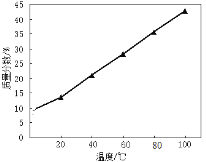
(4)随温度升高溶液中Na2S最高含量如图所示,工业上加热滤液到100 ℃以上但只蒸发到含Na2S 38%—39%,然后冷却结晶,其原因是 。
(5)干燥需要在真空中操作,其原因是 。
【答案】除标注外每空2分
(1)① Na2SO4+2C![]() Na2S+2CO2
Na2S+2CO2
燃烧为反应提供热量(1分)
②及时排出产生的气体,排尽设备中空气(1分)
(2)抑制Na2S水解,防止产生H2S污染
(3)回收滤渣中的硫化物,提高利用率和防止造成污染
(4)浓度低会使Na2S在溶液中残留过多造成产量低,浓度高会导致更多杂质沉淀
(5)防止干燥过程中被空气中的氧气氧化
【解析】
试题分析:
(1)反应物是Na2SO4和C,产物是Na2S和CO2,其中氧化产物在下一个问题中给出;反应需要加热,故煤粉的另一个作用是产生热量,使反应进行;空气中的氧气和二氧化碳均会与Na2S反应,所以应及时排出产生的CO2气体,排尽设备中空气;
(2)Na2S容易水解且水解呈碱性,碱过量能抑制水解;
(3)回收滤渣中的硫化物,提高利用率和防止造成污染;
(4)浓度低溶液量多,残留硫化钠也就多;蒸发到浓度很大时溶解在水中的杂质就会析出,使产物带有杂质;(5)硫化物具有很强的还原性,能被空气中的氧气氧化,同时硫化钠易吸收空气中水分而水解,所以需要隔离空气,即真空中干燥。

【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:
利用如图装置测定化学反应速率(已知:S2O32-+2H+═H2O+S↓+SO2↑)

(1)除如图装置所示的实验用品外,还需要的一种实验用品是________。
A.温度计 B.秒表 C.酒精灯
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__________。
实验二:
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(3)表中Vx=____mL,t1、t2、t3的大小关系是________。
实验三:
取5mL0.1mol/L的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液溶液2mL,发生如下反应:2Fe3++2I-==2Fe2++I2.为证明该反应达到一定可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色(AgI)沉淀;
②再取少量反应液,滴加少量CCl4,振荡,发现CCl4层显浅紫色.
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度.
(4)指导老师指出他们上述实验中①不合理,你认为其原因是___________ ;改进的方法是__________ 。
(5)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是______________________ 。
【题目】下表列出了①~⑥六种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请按要求回答下列问题:
(1)写出①的元素符号___________________。
(2)⑥的原子结构示意图是_______________。
(3)写出③与⑤的单质反应的化学方程式__________________________。
(4)③和④中金属性较弱的是_______________(填化学式)。

