题目内容
【题目】常温下,用0.01000 mol·L-1的盐酸滴定0.01000 mol·L-1NaA溶液20.00mL。滴定曲线如图所示,下列说法错误的是( )
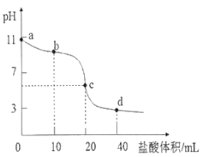
A. 当滴入盐酸以后,c(HA)+c(A-)<0.01000 mol·L-1
B. b点溶液中微粒浓度大小关系为:c(HA)>c(A-)>c(Cl -)>c(OH-)>c(H+)
C. c点时,溶液中微粒浓度关系为:c(Na+)<c(HA)+2c(A-)
D. d点时,溶液中微粒浓度存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(A-)
【答案】B
【解析】
A、根据物料守恒可知,开始时c(HA)+c(A-)=0.01000 mol·L-1,但随着盐酸的加入,溶液的体积增大,c(HA)+c(A-)<0.01000 mol·L-1,故A不符合题意;
B、b点时,加入盐酸的体积为10mL,此时反应后的溶质为HA、NaA、NaCl,且三者物质的量相等,此时溶液显碱性,说明A-的水解大于HA的电离,所以溶液中微粒浓度的大小顺序为c(HA)>c(Cl -)>c(A-)>c(OH-)>c(H+),故B符合题意;
C、c点时,两者恰好反应,溶液中的溶质为HA和NaCl,且两者的物质的量相等,根据物料守恒有c(Na+)=c(HA)+c(A-),所以c(Na+)<c(HA)+2c(A-),故C不符合题意;
D、d点时,溶质为HA、HCl、NaCl,且物质的量相等,根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(A-),故D不符合题意;
综上所述,本题应选B。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目