题目内容
(15分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
⑴I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
⑵一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 ,
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
⑶从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)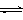 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
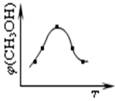
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
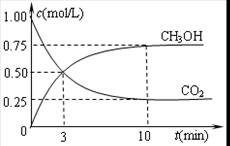
②在容积为1L的恒温密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g) (保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)
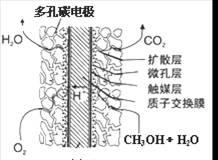
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
⑴5CO(g) + I2O5(s)=5CO2(g) + I2(s) △H=-1377.22kJ·mol-1(3分)
⑵b (2分) 2.67或8/3(3分)
⑶ ①<(2分) ②不(2分) ③CH3OH-6e-+H2O=6H++CO2(3分)
【解析】(1)考查盖斯定律的应用。根据反应①2I2(s) + 5O2(g)= 2I2O5(s)和反应②2CO(g) + O2(g)= 2CO2(g)可知,②×2.5-①÷2即得到5CO(g) + I2O5(s)=5CO2(g) + I2(s),所以该反应的反应热是-566.0 kJ·mol-1×2.5+75.56 kJ·mol-1÷2=-1377.22kJ·mol-1。
(2)反应NO2(g)+SO2(g) SO3(g)+NO(g)是体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。 则
SO3(g)+NO(g)是体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。 则
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1 2 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 2-x x x
所以有 ,解得x=0.8
,解得x=0.8
所以平衡常数为
(3)①根据图像可知,当甲醇的含量达到最大值时,如果继续升高温度,甲醇的含量反而降低,这说明升高温度平衡向逆反应方向移动,即正反应是放热反应。
②根据图像可知平衡时CO2、氢气、甲醇和水蒸气的物质的量分别是0.25mol、0.75mol、0.75mol和0.75mol,所以平衡常数为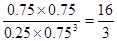 。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g),则此时
。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g),则此时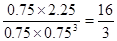 ,所以平衡不移动。
,所以平衡不移动。
(3)甲醇失电子,所以在负极通入。根据电解质可知,负极电极反应式为CH3OH-6e-+H2O=6H++CO2。

 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.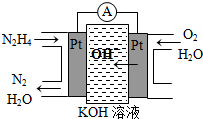 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.