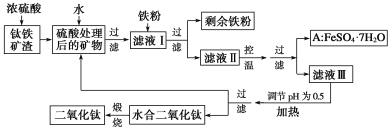
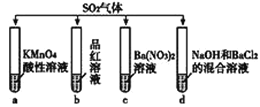
题目内容
【题目】有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是
A. 确定化学式→确定实验式→确定结构式→分离、提纯
B. 分离、提纯→确定化学式→确定实验式→确定结构式
C. 分离、提纯→确定结构式→确定实验式→确定化学式
D. 分离、提纯→确定实验式→确定分子式→确定结构式
【答案】D
【解析】试题要分析有机物的组成及结构,必须先制得这种物质,才能对其进行分析研究故需先将有机混合物分离、提纯;再确定该物质的组成元素,进而确定其最简式(实验式);接着测出分子量确定化学式,再分析它的化学性质或者采用高科技测定方法,从而确定它的结构式;故D项正确;本题选D。

 名校课堂系列答案
名校课堂系列答案【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反应①中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:____________________该反应的平衡常数K3=_______________ 。 (反应①和反应②对应的平衡常数为K1和K2)
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如图所示表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=_____。

(4)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤与水蒸气反应得到煤的气化产物(水煤气),再合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:_______________________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g) ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH=_____________。
CH3OCH3(g) + CO2 (g)的ΔH=_____________。
(3)已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭恒容容器中加入CH3OH ,反应到某时刻测得各组分浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭恒容容器中加入CH3OH ,反应到某时刻测得各组分浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = ______ ;该时间内反应速率v(CH3OH) = _______________________________。
③下列措施中能说明反应达到平衡状态的是___________
A.体系压强保持不变
B.混合气体的密度保持不变
C.CH3OH与H2O的浓度之比为1∶2
D.单位时间内,消耗2mol CH3OH的同时消耗1molH2O