题目内容
为了防止环境污染并对尾气进行综合利用,硫酸厂常用两种方法吸收尾气中的SO2、SO3等气体。方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。已知(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃,欲测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出,测得有关实验数据以下:
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
① | 7.24 | 50.0 | 1.792 |
② | 14.48 | 50.00 | 3.584 |
③ | 21.72 | 50.00 | 4.032 |
④ | 28.96 | 50.00 | 3.136 |
(1)若取3.62 g样品用同种方法实验时,生成氨气的体积(标准状况)为__________L。
(2)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为__________。
(3)求所用NaOH溶液的物质的量浓度(写出计算过程)。
方法二:用NaOH溶液、石灰及O2吸收尾气SO2,以制取石膏(CaSO4·2H2O),此过程的中间产物是NaHSO3。实际操作中以调节尾气排放的流量来取得SO2与NaOH间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。试写出n(SO2)/n(NaOH)在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)的关系式,填入下表:
n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
|
|
(1)0.896
(2)1∶2
(3)6 mol·L-1?
n(SO2)/n(NaOH) | n(NaHSO3) |
≤0.5 | 0 |
0.5—1 | n(NaHSO3)=2n(SO2)-n(NaOH) |
≥1 | n(NaHSO3)=n(NaOH) |
解析:(1)![]() V(NH3)=0.896 L
V(NH3)=0.896 L
(2)设(NH4)2SO4和NH4HSO4的物质的量分别为x、y,据题意:

解得![]()
(3)由于NH4HSO4====![]() +H++
+H++![]()
(NH4)2SO4====2![]() +
+![]()
加入NaOH发生如下反应:

样品质量越多,所含NH4HSO4越多,NaOH不足时,产生NH3越少。设21.72 g样品中所含NH4HSO4的物质的量为x,则28.96 g样品中NH4HSO4的物质的量为![]() x,据题意,得
x,据题意,得
x+![]() mol=
mol=![]() x+
x+![]() mol
mol
x=0.12 mol
n(NaOH)=0.12 mol+![]() =0.30 mol
=0.30 mol
c(NaOH)=![]() =6 mol·L-1
=6 mol·L-1
由SO2+2NaOH====Na2SO3+H2O①
SO2+NaOH====NaHSO3②
![]() ≤
≤![]() 时,只发生反应①,n(NaHSO3)=0
时,只发生反应①,n(NaHSO3)=0
![]() <
<![]() <1时,发生反应①②,Na2SO3、NaHSO3共存,没物质的量分别为x、y,据Na、S守恒得
<1时,发生反应①②,Na2SO3、NaHSO3共存,没物质的量分别为x、y,据Na、S守恒得

解得y=2n(SO2)-n(NaOH)
若![]() ≥1时,SO2过量,按NaOH计算NaHSO3的物质的量。
≥1时,SO2过量,按NaOH计算NaHSO3的物质的量。

 阅读快车系列答案
阅读快车系列答案(1)方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体.为测定生成的(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该混合物样品4份,分别加入等浓度的NaOH溶液50.00mL,使生成的氨气全部逸出,测得有关实验数据如下:
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
(2)方法二:用NaOH溶液、石灰及O2吸收尾气SO2,以制取石膏(CaSO4?2H20),此过程的中间产物是NaHSO3.调节尾气排放的流量可获得SO2与NaOH物质的量的最佳比,从而提高亚硫酸氢钠的产量.如图表示n(NaHSO3) 随n(SO2)/n(NaOH)不同值时的变化曲线.请填写下列空白:
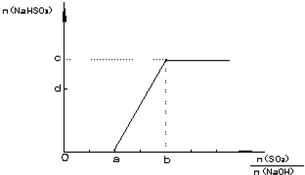
①a=
②c=
实验 | 序号样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测,1.81 g样品进行同样实验时,生成氨气的体积(标况)为________ L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(3)求所有NaOH溶液的物质的量浓度为___________ mol·L-1。
方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。已知SO2及(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃,欲测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出,测得有关实验数据如下:
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
① | 7.24 | 50.00 | 1.792 |
② | 14.48 | 50.00 | 3.584 |
③ | 21.72 | 50.00 | 4.032 |
④ | 28.96 | 50.00 | 3.136 |
(1)若取3.62 g样品用同样方法实验时,生成氨气的体积(标准状况)为_________L。
(2)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为_________。
(3)求所用NaOH溶液的物质的量浓度_________。
方法二:用NaOH溶液、石灰及O2吸收尾气,以制取石膏(CaSO4·2H2O),此过程的中间产物是NaHSO3。实际操作中以调节尾气排放的流量来取得SO2与NaOH间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。试写出n(SO2)/n(NaOH)在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)的关系式,填入下表:
n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
(12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔;为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
为 L。
(2)14.48g该混合物中n((NH4)2SO4)= mol n(NH4HSO4)= mol
(3)第4组中过量的NH4+ 的物质的量为: mol