��Ŀ����
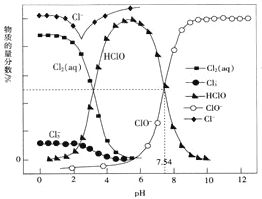
����Ŀ�������£��ı�0.1mol��L-1��Ԫ����H2A��Һ��pH����Һ�е�H2A��HA-��A2-�����ʵ�������![]() (X)��pH�ı仯��ͼ��ʾ[��֪
(X)��pH�ı仯��ͼ��ʾ[��֪![]() (X) =
(X) =![]() ]�����������������( )
]�����������������( )

A. pH=1.2ʱ��c(K+)+c(H+)=c(H2A)+c(OH-)
B. �����£�H2A�ĵ���ƽ�ⳣ��Ka2=10-42
C. pH=2.7ʱ��c(HA-)��c(H2A)=c(A2-)
D. KHA��Һ������Ũ��Ϊc(K+)��c(HA-)��c(OH-)��c(H2A)��c(H+)��c(A2-)
���𰸡�D
��������
��ͼ���֪��pH=1.2ʱ��c��H2A��=c��HA-����pH=2.7ʱ��c��H2A��=c��A2-����pH=4.2ʱ��c��HA-��=c��A2-��������pH������c��H2A����С��c��HA-����������С��c��A2-��������ϵ���ƽ�ⳣ���Լ�������ݼ��㣬�ɸ���������Ƚ�Ũ�ȴ�С��
A���ͼ���֪��pH=1.2ʱ��c��H2A��=c��HA-����c(A2-)=0�������غ��ϵΪc��K+��+c��H+��=c��OH-��+ c��HA-������c��K+��+c��H+��=c��OH-��+ c��H2A������A��ȷ��
B���ͼ���֪��pH=4.2ʱ��c��H+��=10-4.2mol/L��c��HA-��=c��A2-����K2��H2A��=![]() =c��H+��=10-4.2����B��ȷ��
=c��H+��=10-4.2����B��ȷ��
C���ͼ���֪��pH=2.7ʱ��c��H2A��=c��A2-���������������ݿ�֪c��HA-����c��H2A��=c��A2-������C��ȷ��
D���ͼ���֪��KHA��Һ�����ԣ�˵����Һ��HA-�������ˮ�⣬��c��H+����c��OH-����c��A2-����c��H2A������D����
��ѡD��

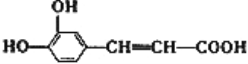
����Ŀ��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᡣ��Ӧԭ��:
![]() +2KMnO4
+2KMnO4![]()
![]() +KOH+
+KOH+
2MnO2��+H2O
![]() +HCl
+HCl![]()
![]() +KCl
+KCl
ʵ�鷽��:һ�����ļױ���KMnO4��Һ��100 ����Ӧһ��ʱ���ֹͣ��Ӧ,���������̷����������ͻ���δ��Ӧ�ļױ���
![]()
��֪:�����������122,�۵�122.4 ��,��25 ����95 ��ʱ�ܽ�ȷֱ�Ϊ0.3 g��6.9 g;���������л���һ�㶼�й̶��۵㡣
(1)��������������,����������������
(2)��ɫҺ��A����������,���Լ���A���Լ�����������,�������� ��
(3)�ⶨ��ɫ����B���۵�,��������115 ����ʼ�ۻ�,�ﵽ130 ��ʱ�����������ۡ���ͬѧ�Ʋ��ɫ����B�DZ�������KCl�Ļ����,��������·��������ᴿ�ͼ���,ʵ���������Ʋ���ȷ������ɱ������ݡ�
��� | ʵ�鷽�� | ʵ������ | ���� |
�� | ����ɫ����B����ˮ��,�����ܽ�,������ | �õ���ɫ�������ɫ��Һ | |
�� | ȡ������Һ���Թ���,�������� | ���ɰ�ɫ���� | ��Һ��Cl- |
�� | �����ɫ����,������ | ������ | ��ɫ���� |
(4)���Ȳⶨ:��ȡ1.220 g��Ʒ,���100 mL�״���Һ,��ȡ25.00 mL��Һ,�ζ�,����KOH�����ʵ���Ϊ2.40��10-3mol����Ʒ�б��������������ļ������ʽΪ��������,������Ϊ��������(������λ��Ч����)��