题目内容
1898年,曾有人发明了固氮的一种方法,该法以石灰石、焦炭、空气为原料。第一步反应是石灰石分解;第二步是使第一步反应产物和焦炭反应,在电炉中的高温下制得第三步反应起始物;第三步反应中另一反应物是空气,该反应也是在电炉中完成的,生成一种固体;第四步是使该固体和水蒸气反应制得氨气。又知该固体中有与N3-互为等电子体的离子。(1)试写出四步反应的化学方程式;
(2)试简评该固氮方法。
(2)试简评该固氮方法。
(1)CaCO3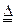 CaO+CO2↑; CaO+3C
CaO+CO2↑; CaO+3C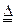 CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2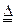 CaCN2+C ; CaCN2+3H2O(g)=CaCO3+2NH3↑。
CaCN2+C ; CaCN2+3H2O(g)=CaCO3+2NH3↑。
(2)这种方法,需要消耗大量电能,原料众多,设备重,生产成本高。
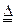 CaO+CO2↑; CaO+3C
CaO+CO2↑; CaO+3C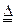 CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2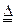 CaCN2+C ; CaCN2+3H2O(g)=CaCO3+2NH3↑。
CaCN2+C ; CaCN2+3H2O(g)=CaCO3+2NH3↑。(2)这种方法,需要消耗大量电能,原料众多,设备重,生产成本高。
前二步反应分别是石灰石的分解和制造电石的反应:
CaCO3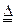 CaO+CO2↑; CaO+3C
CaO+CO2↑; CaO+3C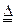 CaC2+CO↑
CaC2+CO↑
第三步反应是CaC2在高温下与空气中的氮气反应,以取得固氮的效果。由于生成物与N3-互为等电子体的离子,氮元素在此生成物中应为-3价,后者与水反应才更有可能生成NH3。N3-的等电子体有CN22-、C2N3-。如果N为-3价,在CN22-中C为+4价,在C2N3-中C为0价,不合理,因此生成物中的该离子只能为CN22-。其化学方程式为:
CaC2+N2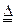 CaCN2+C ; CaCN2+3H2O=CaCO3+2NH3↑。
CaCN2+C ; CaCN2+3H2O=CaCO3+2NH3↑。
这种方法较之现在的合成氨工业,需要消耗大量电能,原料众多,生产成本高,因此,很快被合成氨的催化法代替。
CaCO3
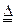 CaO+CO2↑; CaO+3C
CaO+CO2↑; CaO+3C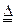 CaC2+CO↑
CaC2+CO↑第三步反应是CaC2在高温下与空气中的氮气反应,以取得固氮的效果。由于生成物与N3-互为等电子体的离子,氮元素在此生成物中应为-3价,后者与水反应才更有可能生成NH3。N3-的等电子体有CN22-、C2N3-。如果N为-3价,在CN22-中C为+4价,在C2N3-中C为0价,不合理,因此生成物中的该离子只能为CN22-。其化学方程式为:
CaC2+N2
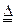 CaCN2+C ; CaCN2+3H2O=CaCO3+2NH3↑。
CaCN2+C ; CaCN2+3H2O=CaCO3+2NH3↑。这种方法较之现在的合成氨工业,需要消耗大量电能,原料众多,生产成本高,因此,很快被合成氨的催化法代替。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
 O2恰好完全转化为HNO3,则需通入O2的总体积为 升。
O2恰好完全转化为HNO3,则需通入O2的总体积为 升。 体体积均在相同条件下测定)
体体积均在相同条件下测定)
 氮的叙述正确的是
氮的叙述正确的是