题目内容
(7分)NO2溶于水生成HNO3和NO,工业上利用这一反应原理制取HNO3 。
3NO2+H2O=2HNO3+NO (第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2,工业上通常把生成的NO再次氧化为NO2,再次用水吸收
2NO+O2=2NO2 (第一次通O2)
3NO2+H2O=2HNO3+NO (第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2,如果按上述方法进行循环氧化吸收:
(1)则第二次吸收后,NO2的总吸收百分率为 (可以用分数表示,下同),第二次通入O2的体积为 升,第三次吸收后还剩余NO 升。
(2)第n次吸收后剩余NO的体积为 升(用含n的代数式表示)。
(3)如果要使3升N O2恰好完全转化为HNO3,则需通入O2的总体积为 升。
O2恰好完全转化为HNO3,则需通入O2的总体积为 升。
(所有气 体体积均在相同条件下测定)
体体积均在相同条件下测定)
3NO2+H2O=2HNO3+NO (第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2,工业上通常把生成的NO再次氧化为NO2,再次用水吸收
2NO+O2=2NO2 (第一次通O2)
3NO2+H2O=2HNO3+NO (第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2,如果按上述方法进行循环氧化吸收:
(1)则第二次吸收后,NO2的总吸收百分率为 (可以用分数表示,下同),第二次通入O2的体积为 升,第三次吸收后还剩余NO 升。
(2)第n次吸收后剩余NO的体积为 升(用含n的代数式表示)。
(3)如果要使3升N
 O2恰好完全转化为HNO3,则需通入O2的总体积为 升。
O2恰好完全转化为HNO3,则需通入O2的总体积为 升。(所有气
 体体积均在相同条件下测定)
体体积均在相同条件下测定)(10分)(1)8/9, 1/6 , 1/9 。 (2) 1/(3n-1)。 (3)3/4。
略

练习册系列答案
相关题目
 + HNO2 → HN3(叠氮酸) + H2O (未配平);
+ HNO2 → HN3(叠氮酸) + H2O (未配平);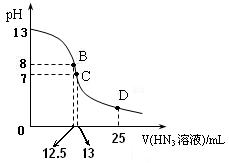
 D点时溶液中各离子的浓度由大到小的顺序为
D点时溶液中各离子的浓度由大到小的顺序为  (HN3
(HN3 ) =
) =  程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,