题目内容
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
(1)用甲烷催化还原一氧化氮,可以消除一氧化氮对大气的污染.反应方程式如下:CH4(g)+4NO(g)?2N2(g)+2H2O(g)+CO2(g)该反应平衡常数表达式为______.
(2)硫酸生产中,接触室内的反应:2SO2(g)+O2(g) 2SO3(g);SO2的平衡转化率与体系总压强的关系如图1所示.某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是______mol?L-1?min-1.
2SO3(g);SO2的平衡转化率与体系总压强的关系如图1所示.某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是______mol?L-1?min-1.
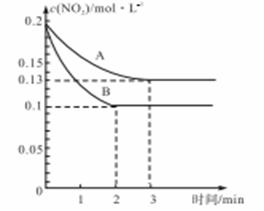
(3)右图平衡状态由A变到B时,改变的外界条件是______.
a.又加入一些催化剂 b.又加入一些氧气 c.降低了体系的温度 d.升高了外界的大气压
(4)新型纳米材料氧缺位铁酸盐MFe2Ox在常温下,能将氮的氧化物和SO2等废气分解除去.转化流程如图2所示,若x=3.5,M为Zn,请写出ZnFe2O3.5分解SO2的化学方程式______.
(1)该反应平衡常数表达式为:K=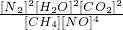 ,
,
故答案是:K=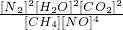 ;
;
(2)此时二氧化硫的转化率是0.8,根据反应2SO2(g)+O2(g) 2SO3(g),消耗氧气的物质的量是:n(O2)=
2SO3(g),消耗氧气的物质的量是:n(O2)= ×n(SO2)=0.5×2.0mol×0.8=0.8mol,消耗氧气的浓度是:c(O2)=
×n(SO2)=0.5×2.0mol×0.8=0.8mol,消耗氧气的浓度是:c(O2)=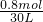 ≈0.02667mol/L,用氧气表示反应速率为:
≈0.02667mol/L,用氧气表示反应速率为: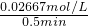 =0.0533mol?L-1?min-1,
=0.0533mol?L-1?min-1,
故答案是:0.0533
(3)a、又加入一些催化剂,催化剂不影响化学平衡,故a错误;
b、又加入一些氧气,气体物质的量增大,压强增大;反应物氧气浓度增大,二氧化硫的转化率升高,故b正确;
c、反应是放热反应,降低温度,平衡向着正向移动,气体的物质的量减少,压强减小,故c错误;
d、升高了外界的大气压,化学平衡不移动,故d错误;
故选b;
(4)由题意可知,铁酸盐(MFe2O4)经高温还原而得,则反应物中MFe2Ox为还原剂,SO2为氧化剂,生成物为MFe2O4和S,则反应的关系式为MFe2Ox+SO2→MFe2O4+S,
故答案为:MFe2Ox+SO2→MFe2O4+S.
分析:(1)可以根据平衡常数表达式完成;
(2)根据反应2SO2(g)+O2(g) 2SO3(g)及总压强为2.70MPa时二氧化硫的转化率计算出用氧气表示的反应速率;
2SO3(g)及总压强为2.70MPa时二氧化硫的转化率计算出用氧气表示的反应速率;
(3)状态由A变到B时,二氧化硫转化率升高,压强增大,根据平衡移动原理分析;
(4)从氧化还原反应的角度判断反应产物,进而写出相关反应的方程式.
点评:本题考查了化学平衡常数、平衡转化率、影响化学平衡的外界条件综合应用及知识迁移能力等考点,题目难度中等.
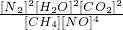 ,
,故答案是:K=
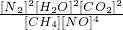 ;
;(2)此时二氧化硫的转化率是0.8,根据反应2SO2(g)+O2(g)
 2SO3(g),消耗氧气的物质的量是:n(O2)=
2SO3(g),消耗氧气的物质的量是:n(O2)= ×n(SO2)=0.5×2.0mol×0.8=0.8mol,消耗氧气的浓度是:c(O2)=
×n(SO2)=0.5×2.0mol×0.8=0.8mol,消耗氧气的浓度是:c(O2)=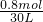 ≈0.02667mol/L,用氧气表示反应速率为:
≈0.02667mol/L,用氧气表示反应速率为: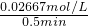 =0.0533mol?L-1?min-1,
=0.0533mol?L-1?min-1,故答案是:0.0533
(3)a、又加入一些催化剂,催化剂不影响化学平衡,故a错误;
b、又加入一些氧气,气体物质的量增大,压强增大;反应物氧气浓度增大,二氧化硫的转化率升高,故b正确;
c、反应是放热反应,降低温度,平衡向着正向移动,气体的物质的量减少,压强减小,故c错误;
d、升高了外界的大气压,化学平衡不移动,故d错误;
故选b;
(4)由题意可知,铁酸盐(MFe2O4)经高温还原而得,则反应物中MFe2Ox为还原剂,SO2为氧化剂,生成物为MFe2O4和S,则反应的关系式为MFe2Ox+SO2→MFe2O4+S,
故答案为:MFe2Ox+SO2→MFe2O4+S.
分析:(1)可以根据平衡常数表达式完成;
(2)根据反应2SO2(g)+O2(g)
 2SO3(g)及总压强为2.70MPa时二氧化硫的转化率计算出用氧气表示的反应速率;
2SO3(g)及总压强为2.70MPa时二氧化硫的转化率计算出用氧气表示的反应速率;(3)状态由A变到B时,二氧化硫转化率升高,压强增大,根据平衡移动原理分析;
(4)从氧化还原反应的角度判断反应产物,进而写出相关反应的方程式.
点评:本题考查了化学平衡常数、平衡转化率、影响化学平衡的外界条件综合应用及知识迁移能力等考点,题目难度中等.

练习册系列答案
相关题目
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:

 的情报况如下图所示,请回答:
的情报况如下图所示,请回答: