题目内容
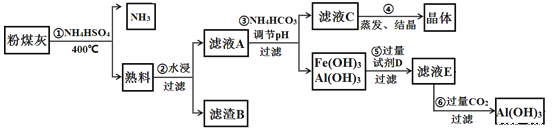
【题目】粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,写出反应的离子方程式:____________。
(2)滤渣B的主要成分为_____________。
(3) 已知Ksp[Fe(OH)3]=4×10-38,Ksp [Al(OH)3]=1×10-33。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-9 molL﹣1可认为完全沉淀,则溶液A至少应调节到pH=_____________。用NH4HCO3调节pH的实验原理为_____________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、__________、_____________。
【答案】(1)Fe2O3+4NH4HSO4![]() 2NH4Fe(SO4)2+2NH3↑+3H2O(2分)
2NH4Fe(SO4)2+2NH3↑+3H2O(2分)
2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+NH3H2O+Al(OH)3↓(3分)
(2)SiO2(2分)(3)6(3分)H++HCO3-=H2O+CO2↑(2分)
(4)玻璃棒(1分)蒸发皿(1分)
【解析】
试题分析:(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水,反应的化学方程式为Fe2O3+4NH4HSO4![]() 2NH4Fe(SO4)2+2NH3↑+3H2O;在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,则还会生成氨水和氢氧化铝沉淀,反应的离子方程式为2Ba2++4OH﹣+NH4++Al3++2SO42﹣=2BaSO4↓+NH3H2O+Al(OH)3↓;
2NH4Fe(SO4)2+2NH3↑+3H2O;在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,则还会生成氨水和氢氧化铝沉淀,反应的离子方程式为2Ba2++4OH﹣+NH4++Al3++2SO42﹣=2BaSO4↓+NH3H2O+Al(OH)3↓;
(2)SiO2不溶于一般酸性溶液,不溶于氨水,因此滤渣B的主要成分为SiO2;
(3)根据KSP[Al(OH)3]=1×10﹣33;c(Al3+)均小于或等于1×10﹣9 molL﹣1可认为完全沉淀,c(OH﹣)=![]() mol/L=1×10﹣8mol/L,则常温下溶液的pH=6;在酸性溶液中发生H++HCO3﹣=H2O+CO2↑,所以可以用NH4HCO3调节pH;
mol/L=1×10﹣8mol/L,则常温下溶液的pH=6;在酸性溶液中发生H++HCO3﹣=H2O+CO2↑,所以可以用NH4HCO3调节pH;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿。

 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案