题目内容
(2011?武昌区模拟)一定条件下,可逆反应:N2(g)+3H2(g) 2NH3(g);△H<0,达到化学平衡后,改变某一条件时,下列说法错误的是( )
2NH3(g);△H<0,达到化学平衡后,改变某一条件时,下列说法错误的是( )
 2NH3(g);△H<0,达到化学平衡后,改变某一条件时,下列说法错误的是( )
2NH3(g);△H<0,达到化学平衡后,改变某一条件时,下列说法错误的是( )分析:首先分析反应的特征,该反应的正反应为放热反应,反应物气体的计量数之和大于生成物气体的计量数之和,在此基础上,从催化剂、温度、压强等角度对反应速率和平衡移动的影响分析.
解答:解:A、催化剂能同等程度增大反应速率,加入催化剂,平衡不移动,故A正确;
B、降价温度,正逆反应速率都减小,平衡向正反应方向移动,则v(正)、v(逆)都减小,且v(正)减小倍数小于v(逆)减小倍数,故B正确;
C、增大压强,正逆反应速率都增大,由于反应物气体的计量数之和大于生成物气体的计量数之和,则平衡向正反应方向移动,v(正)增大倍数大于v(逆)增大倍数,故C正确;
D、氩气为惰性气体,若为恒容下通入氩气,对反应速率和平衡移动都没有影响,故D错误.
故选D.
B、降价温度,正逆反应速率都减小,平衡向正反应方向移动,则v(正)、v(逆)都减小,且v(正)减小倍数小于v(逆)减小倍数,故B正确;
C、增大压强,正逆反应速率都增大,由于反应物气体的计量数之和大于生成物气体的计量数之和,则平衡向正反应方向移动,v(正)增大倍数大于v(逆)增大倍数,故C正确;
D、氩气为惰性气体,若为恒容下通入氩气,对反应速率和平衡移动都没有影响,故D错误.
故选D.
点评:本题考查外界条件对反应速率和平衡移动的影响,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
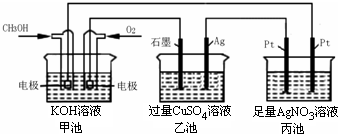 (2011?武昌区模拟)如图所示,下列说法正确的是( )
(2011?武昌区模拟)如图所示,下列说法正确的是( )



