题目内容
【题目】硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O俗称“莫尔盐”,是一种重要化学试剂,实验室用废铁屑来模拟工业制取莫尔盐,流程如下:
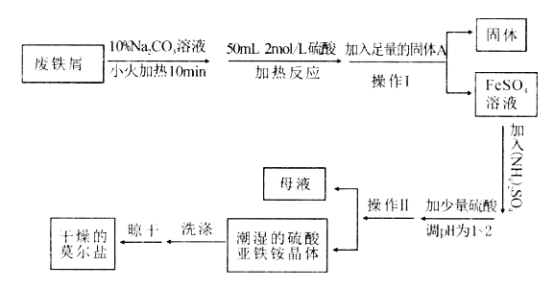
请回答下列问题:
(1)加入10% Na2CO3溶液的作用是_________.
(2)A物质为________.
(3)加少量硫酸调节pH 为1-2 的目的是_______,操作Ⅱ 的名称是________。
(4)根据计算,理论上需加入硫酸铵的质量为_________g .
(5)洗涤潮湿的硫酸亚铁铵晶体所用的试剂最好为___________(填宇母)。
A. 蒸馏水 B. 无水乙醇 C. 稀硫酸 D. 硫酸铵溶液
【答案】 洗去铁屑表面的油污 Fe 抑制Fe2+、NH4+水解 蒸发浓缩、冷却结晶、过滤 13.2g B
【解析】实验室用含油污的铁屑来制取莫尔盐:碳酸钠水解显碱性,油脂在碱性溶液中水解生成溶于水的物质易于洗去,步骤1中加入10Na2CO3溶液的主要作用是除去铁屑表面的油污,洗净,再加入过量硫酸溶解Fe,然后添加过量Fe粉,除去溶液中可能被氧化生成的Fe3+,过滤得到固体为过量的铁,滤液为FeSO4,相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小,所以将硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,加入少量硫酸可以调节pH为1~2是抑制亚铁离子和铵根离子水解,Fe2++2H2OFe (OH)2+2H+; NH4++H2ONH3H2O+H+;加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解得到更多的产品;莫尔盐,易溶于水,不溶于乙醇,用乙醇洗涤干燥得到莫尔盐;
(1)油污的主要成分为油脂,在碱性条件下易发生水解,而Na2CO3为强碱弱酸盐,CO32-+H2OHCO3-+OH-,溶液呈碱性,可用于洗去铁屑表面的油污;
(2) 添加A物质是为了将溶液中可能存在的Fe3+还原为Fe2+,结合除杂原则,A为Fe;
(3)溶液中Fe2+和NH4+均易水解,加少量硫酸调节pH 为1-2,可抑制Fe2+、NH4+水解;可通过蒸发浓缩、冷却结晶、过滤操作从溶液中获得的晶体;
(4)用稀硫酸溶解Fe时消耗硫酸的物质的量2mol/L×0.05L=0.1mol,生成硫酸亚铁的物质的量为0.1mol,则添加硫酸铵的物质的量为0.1mol,质量为0.1mol×132g/mol=13.2g;
(5)硫酸亚铁铵晶体,易溶于水,不溶于乙醇,可用乙醇洗涤干燥得到莫尔盐,故答案为B。