题目内容
10.已知有以下物质相互转化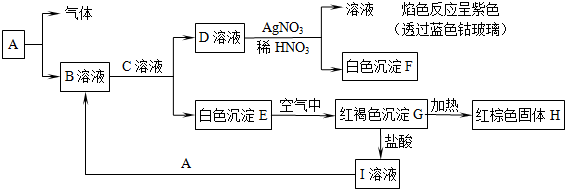
试回答:
(1)写出A的化学式Fe,D的化学式KCl.
(2)写出由E转变成G的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)鉴定I中阳离子的实验方法和现象:取少许I溶液于试管中,滴加KSCN溶液,溶液呈红色即可鉴别含Fe3+,.
(4)写出将B溶液转化为I溶液的离子方程式2Fe2++Cl2=2Fe2++2Cl-.
分析 由转化关系可知,白色沉淀E在空气中转化红褐色沉淀G,则E为Fe(OH)2,G为Fe(OH)3,加热G生成红褐色固体H为Fe2O3,G与盐酸反应生成I为FeCl3.由溶液F与硝酸银、硝酸溶液反应生成白色沉淀F,且所得溶液焰色反应为紫色,故含有K+,白色沉淀F为AgCl,D为KCl,由溶液B+溶液C→KCl+Fe(OH)2,为FeCl2与KOH,而溶液I+A→溶液B,则B为FeCl2,E为KOH,A为Fe,Fe与盐酸反应生成氯化亚铁与氢气,据此解答.
解答 解:由转化关系可知,白色沉淀E在空气中转化红褐色沉淀G,则E为Fe(OH)2,G为Fe(OH)3,加热G生成红褐色固体H为Fe2O3,G与盐酸反应生成I为FeCl3.由溶液F与硝酸银、硝酸溶液反应生成白色沉淀F,且所得溶液焰色反应为紫色,故含有K+,白色沉淀F为AgCl,D为KCl,由溶液B+溶液C→KCl+Fe(OH)2,为FeCl2与KOH,而溶液I+A→溶液B,则B为FeCl2,E为KOH,A为Fe,Fe与盐酸反应生成氯化亚铁与氢气.
(1)A的化学式为Fe,D的化学式为KCl,故答案为:Fe;KCl;
(2)由E转变成G的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)鉴定FeCl3中阳离子的实验方法和现象:取少许I溶液于试管中,滴加KSCN溶液,溶液呈红色即可鉴别含Fe3+,
故答案为:取少许I溶液于试管中,滴加KSCN溶液,溶液呈红色即可鉴别含Fe3+,;
(4)将B溶液转化为I溶液的离子方程式:2Fe2++Cl2=2Fe2++2Cl-,故答案为:2Fe2++Cl2=2Fe2++2Cl-.
点评 本题考查无机物推断,涉及Fe、Cl等元素单质及其化合物之间的相互转化关系,E、G、H颜色及溶液焰色反应为紫色等解题突破口,难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑ | B. | Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑ | ||
| C. | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O7 2-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O7 2->Fe3+ | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | CrO42- 和Fe2+在酸性溶液中可以大量共存 |
| A. | 1L0.1mol/L的 Na2S溶液中S2-的个数为0.1NA | |
| B. | 标准状况下,11.2LH2所含的中子数为0.15 NA | |
| C. | 7.8g Na2O2与足量的水反应,转移的电子数为0.2 NA | |
| D. | 1mol羟基所含电子数为9 NA |

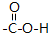 .
.