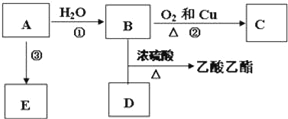
题目内容
【题目】铁橄榄石是天然的铁矿石,可以通过如下反应和相应的数据推知它的化学式。其中A~J是中学化学中的常见物质,G是一种红褐色固体,D是一种难溶于水的含氧酸,J是一种主要的温室气体,A的焰色反应呈黄色,E和B分别与酸化的硝酸银溶液反应时的实验现象相同,均有白色沉淀产生。由实验测得铁橄榄石的摩尔质量为204g ·mol-1,其中铁元素的质量分数为54.9%,流程中的部分生成物已略去。
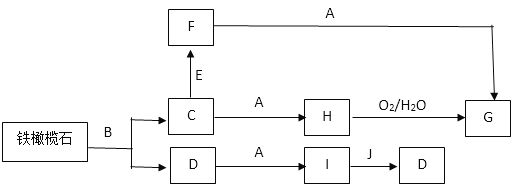
回答下列问题:
(1)A的电子式_____________。
(2)铁橄榄石的化学式_____________。
(3)写出C→F的离子方程式_____________。
(4)写出H→G的化学方程式_____________。
【答案】 ![]() Fe2SiO4或2FeOSiO2 2Fe2++Cl2=2Fe3++2Cl- 4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe2SiO4或2FeOSiO2 2Fe2++Cl2=2Fe3++2Cl- 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】其中A~J是中学化学中的常见物质,G是一种红褐色固体,G为Fe(OH)3,则H为Fe(OH)2,C为液体盐;D是一种难溶于水的含氧酸,D为H2SiO3,J是一种主要的温室气体,J为CO2,则I为硅酸盐,A的焰色反应呈黄色,A含有钠元素,因此I为Na2SiO3,则A为NaOH;E和B分别与酸化的硝酸银溶液反应时的实验现象相同,均有白色沉淀产生,则EB中均含有氯离子,根据流程图,B为HCl,C为FeCl2,则E为Cl2,根据上述分析,铁橄榄石中含有铁、硅元素,则铁橄榄石为含亚铁离子的硅酸盐,根据摩尔质量为204g ·mol-1,其中铁元素的质量分数为54.9%,则1mol铁橄榄石含有2molFe,结合摩尔质量,铁橄榄石的化学式为Fe2SiO4。
(1)A为NaOH,A的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据上述分析,铁橄榄石的化学式为Fe2SiO4,故答案为:Fe2SiO4;
(3)C→F是亚铁离子被氯气氧化的反应,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)H→G是氢氧化亚铁被氧化的反应,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性。
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
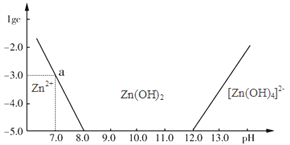
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为:
___________________________________________________________________________
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)= _________________________。
③往1L1.00 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol。
④已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是____________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50 mol·L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
①在25℃下,将a molL—1的NH4Cl溶液与0.01molL—1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=___________mol L—1。
②若25℃时将浓度均为0.1molL—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____________(填字母)。
a.此溶液一定有c(NH4+)+ c ( H+) = c(OH—) +c ( Cl—)
b.此溶液一定有c(Cl-) = c (NH3·H2O) +c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大