题目内容
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH 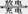 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
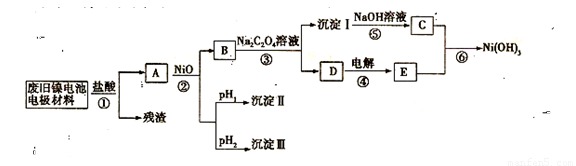
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)x |
Ksp |
pH |
|
|
开始沉淀 |
沉淀完全 |
||
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为 ,后析出的沉淀为Ⅲ为__________________(填化学式),则pH1 pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4 > NiC2O4·H2O > NiC2O4·2H2O,则③的化学方程式是 。
(5)④中阳极的电极反应为 ,验证阳极产物的试剂为 。
(6)试写出⑥的离子方程式 。
(1) MH-e-+OH-=H2O+M (2)Ni(OH)2-e-+OH-=NiOOH+H2O (3)Fe(OH)3 Al(OH)3 <
(4)NiCl2 + Na2C2O4 + 2H2O = NiC2O4. 2H2O↓ + 2NaCl
(5)2Cl—2e-=Cl2↑;淀粉碘化钾溶液(或其它合理答案)。
(6)2Ni(OH)2 + 2OH- + Cl2 = 2Ni(OH)3+ 2Cl-
【解析】
试题分析:(1)放电时,负极发生氧化反应,所以电极反应为:MH-e-+OH-=H2O+M。
(2)充电时,阳极发生氧化反应,所以电极反应为:Ni(OH)2-e-+OH-=NiOOH+H2O
(3)根据Ksp可以看出当pH增大时,Fe(OH)3 最先沉淀,然后是Al(OH)3 最后是Ni(OH)2。所以步骤②先析出的沉淀II是Fe(OH)3后析出的沉淀III是Al(OH)3。pH1< pH2。
(4)根据溶解度可知NiC2O4·2H2O的溶解度最小,所以③的化学方程式为NiCl2 + Na2C2O4 + 2H2O = NiC2O4. 2H2O↓ + 2NaCl。
(5)根据框图可知D为NaCl溶液,所以电解时阳极反应为2Cl—2e-=Cl2↑。检验阳极产物用淀粉碘化钾溶液。
(6)根据框图可知C为Ni(OH)2,所以⑥的离子方程式为:2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+
2Cl-。
考点:化学电源和工业流程
点评:本题综合性强,难度较大,主要考查学生的分析能力和解题能力,是高考的热点习题。

(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 | ⅠA | | | | | | | 0 |
| 1 | | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | D | E | | G | I |
| 3 | A | B | C | | F | | H | |
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH 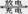 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: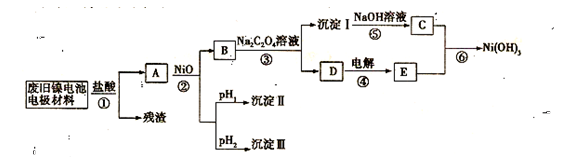
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为 ,后析出的沉淀为Ⅲ为__________________(填化学式),则pH1 pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4 > NiC2O4·H2O > NiC2O4·2H2O,则③的化学方程式是 。
(5)④中阳极的电极反应为 ,验证阳极产物的试剂为 。
(6)试写出⑥的离子方程式 。
 单质与E的最高价氧化物对应水化物反应的化学方程式是 。
单质与E的最高价氧化物对应水化物反应的化学方程式是 。 料电池,此电池的负极反应式是 。
料电池,此电池的负极反应式是 。